
- •1. Атом
- •2. Атомная масса
- •3. Нуклид
- •4. Модель атома по бору и резерфорду
- •5. Принцип неопределенности Гейзенберга
- •6. Уравнение де Бройля
- •7. Уравнение Шредингера
- •8. Волновая функция
- •9. Квантовые числа
- •10. Порядок заполнения орбитали
- •11. Принцип (запрет) Паули
- •12. Правило Хунда
- •13. Периодичность изменения свойств элементов:
- •14. Виды химической связи
- •15. Основные характеристики химической связи: энергия и длина связи
- •16. Ионная связь, ковалентная связь и их особенности
- •17. Полярность связи
- •18. Метод валентных связей
- •19. Донорно-акцепторный механизм образования связи
- •20. Σ,π,δ связи
- •21. Кратные связи. Делокализация связи
- •22. Гибридизация атомных орбиталей. Теория полной гибридизации Гиллеспи
- •23. Пространственная конфигурация молекул
- •24. Полярность молекул
- •25. Метод молкао (молекулярная орбиталь есть линейная комбинация атомных орбиталей)
- •26. Порядок и энергия связь в методе мо лкао
- •27. Водородная связь
9. Квантовые числа
главное квантовое число,латинская буква n , показывает номер энергетического уровня, равно от 1 до бесконечности (на сегодняшний день максимальное значение 7, точно не скажу); орбитальное квантовое число, латинская буква l, указывает на подуровень на уровне и форму орбитали, принимает значения от 0 до (n-1),на сегодня известны s(при l=0),p,d,f,g-орбитали; Магнитное квантовое число, латинская буква m, значения целые от -l,..,0,...l, Спиновое квантовое число, буква s, +1/2 или -1/2
10. Порядок заполнения орбитали
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталейв многоэлектронных атомах.
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
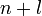 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением 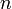 .
.
http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B0%D0%B2%D0%B8%D0%BB%D0%BE_%D0%9A%D0%BB%D0%B5%D1%87%D0%BA%D0%BE%D0%B2%D1%81%D0%BA%D0%BE%D0%B3%D0%BE
11. Принцип (запрет) Паули
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественныхфермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Принцип был сформулирован для электронов Вольфгангом Паули в 1925 г. в процессе работы над квантомеханической интерпретацией аномального эффекта Зеемана и в дальнейшем распространён на все частицы с полуцелым спином. Полное обобщённое доказательство принципа было сделано им в 1940 г. в рамках релятивистской квантовой механики: волновая функция системы фермионов является антисимметричной относительно их перестановок, поведение систем таких частиц описывается статистикой Ферми — Дирака.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
В
статистической физике принцип Паули
иногда формулируется в терминах чисел
заполнения: в системе одинаковых
частиц, описываемых антисимметричной
волновой функцией, числа заполнения
могут принимать лишь два значения ![]()
Строение атомов и принцип Паули
Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количество электронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией (при этом не стоит забывать, что электроны неразличимы, и нельзя сказать, в каком именно квантовом состоянии находится данный электрон). Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1S орбитали (самой низкой по энергии), при этом у них отличаются собственные моменты импульса, и третий электрон не может занимать 1S орбиталь, так как будет нарушен запрет Паули. Поэтому, третий электрон занимает 2S орбиталь (следующая, низшая по энергии, орбиталь после 1S)
