
- •1.Предмет и задачи тд. Модели тд.
- •2.Модели тд. Объяснение агрегатных состояний вещества.
- •3.Методы тд.
- •4.Исходные понятия тд.
- •5.Постулаты термодинамики.
- •6.Начала тд.
- •7.Термическое и калорическое уравнения состояния. Термическое уравнение состояние идеального газа.
- •8.Внутренняя энергия идеального газа. Калорическое уравнение состояние идеального газа.
- •9.I начало термодинамики.
- •I начало тд обобщает закон сохранения энергии для тд процессов: количество теплоты, сообщаемое системе, идет на изменение ее внутренней энергии и совершение системой работы.
- •10.Теплоемкость.
- •11.Теплоемкость идеального газа.
- •12. 13.Теорема о равнораспределении энергии по степеням свободы. Число степеней свободы молекул. Число степеней свободы молекул. Выражение для внутренней энергии идеального газа.
- •14.Изохорический процесс: уравнение, график в pv, pt, vt координатах.
- •15.I начало термодинамики в изохорическом процессе.
- •16.Изобарический процесс: уравнение, график в pv, pt, vt координатах.
- •17. I начало термодинамики в изобарическом процессе.
- •18.Изотермический процесс: уравнение, график в pv, pt, vt координатах.
- •19.I начало термодинамики в изотермическом процессе.
- •20.Адиабатический процесс. Уравнение адиабаты. График адиабаты.
- •21.I начало термодинамики в адиабатическом процессе.
- •22.Политропный процесс. Уравнение политропы, показатель политропы, график политропы.
- •23.I начало термодинамики в политропном процессе.
- •24.Изопроцессы как предельные случаи политропного процесса.
- •25.Обратимые и циклические процессы.
- •26. Тепловые машины. Эффективность работы тепловой машины.
- •27.Холодильные машины. Эффективность работы холодильной машины.
- •28.29.Цикл Карно. К.П.Д. Цикла Карно. Идеальная тепловая машина Карно.
- •30. I Теорема Карно.
- •31.II теорема Карно. Реальные тепловые машины.
- •32.II начало термодинамики в формулировках Кельвина и Клаузиуса.
- •33.Тождество Клаузиуса, неравенство Клаузиуса.
- •34. Понятие энтропии. Свойства энтропии. Размерность.
- •35.Энтропия в обратимых и необратимых процессах.
- •36. Энтропия идеального газа.
- •37.III начало тд. Следствия III начала тд.
- •38.Энтальпия.
- •39.Свободная энергия идеального газа.
- •40.Метод тд потенциалов.
- •С 41 по 46 не разделила!смотреть тут(то что красным)!!!:
- •48.Условия равновесия и устойчивости системы в термостате при постоянном объеме.
- •49.Условия равновесия и устойчивости системы в термостате при постоянном внешнем давлении.
- •50.Условия равновесия и устойчивости системы при постоянных энтропии и давлении.
- •51. Условия равновесия и устойчивости системы при постоянных энтропии и объеме.
- •52.Условия равновесия и устойчивости системы с переменным числом частиц в термостате, при постоянных химическом потенциале и объеме.
- •53. Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
- •54.Принцип Ле Шателье-Брауна. Примеры проявления принципа Ле Шателье-Брауна.
- •55.Начала статистической физики: исходные понятия теории вероятности.
- •56.Начала статистической физики: макро- и микросостояния, статистический ансамбль, микроканонический ансамбль, постулат равновероятности.
- •57.Начала статистической физики: эргодическая гипотеза, статистический вес, статистическое толкование энтропии.
- •58.Начала статистической физики: флуктуации.
- •65.Характерные скорости распределения Максвелла: средняя квадратичная скорость.
- •66.Характерные скорости распределения Максвелла: наиболее вероятная скорость.
- •67. Подсчет числа молекул скорости, которых лежат в заданном диапазоне.
- •68.Экспериментальная проверка закона распределения.
- •69.Вывод основного уравнения молекулярно-кинетической теории идеального газа.
- •70.Вывод уравнения состояния. Закон Дальтона. Закон Авогадро.
- •71.72.( Не разделены!)Распределение Больцмана. (72)Барометрическая формула.
- •73.Экспериментальное определение постоянной Авогадро.
- •74.Теорема о равнораспределении энергии по степеням свободы.
- •75.Расхождение теории теплоемкости идеального газа с экспериментом.
- •76.Статистика Ферми-Дирака (подсчет числа микросостояний, функция распределения).
- •77.Статистика Бозе-Эйнштейна (подсчет числа микросостояний, функция распределения).
- •78.Длина свободного пробега.
- •79.Частота столкновений в единицу времени, понятие физического вакуума.
- •80.Явления переноса: теплопроводность.
- •81.Явления переноса: диффузия.
- •82.Явления переноса: вязкое трение.
- •83.Молекулярная теория явлений переноса: вывод уравнения переноса параметра .
- •84.Молекулярная теория явлений переноса: вывод уравнения коэффициента диффузии.
- •85.Молекулярная теория явлений переноса: вывод уравнения коэффициента теплопроводности.
- •86.Молекулярная теория явлений переноса: вывод уравнения коэффициента вязкости.
- •87.Силы и потенциальная энергия межмолекулярного взаимодействия.
- •88.Вывод уравнения Ван-дер-Ваальса.
- •89.Изотермы Ван-дер-Ваальса.
- •Часть 7—6 — отвечает газообразному состоянию;
- •Часть 2—1 — жидкому;
- •Часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
- •90.Фазовые переходы. Уравнения Клайперона-Клаузиуса.
- •91.Поверхностное натяжение в жидкостях.
- •92.Смачивание
- •93.Капиллярные явления. Формула Лапласса.
- •94.Строение твердых тел. Классификация элементарных ячеек.
- •95.Дефекты кристаллических решеток.
- •96.Температура. Температурные шкалы. Способы измерения.
34. Понятие энтропии. Свойства энтропии. Размерность.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение изменения общего количества тепла ΔQ к величине абсолютной температуры T:
.
![]()
Рудольф Клаузиус дал величине S имя «энтропия», от греческого «энтропос» - возвращение, поворот. Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре).
Её обобщение на случай произвольного квазистатического процесса выглядит так:
в интегральной форме
или в дифференциальной форме , . ,где dS — приращение (дифференциал) энтропии, а δQ — бесконечно малое приращение количества теплоты.
Каждое состояние тела характеризуется определенным значением энтропии .
Тождество Клаузиуса( ) говорит, что при замкнутых обратимых процессах энтропия не меняется.
Энергия сохраняется, поэтому она не может указывать направление процессов. Все реальные процессы необратимы, поэтому в замкнутых системах они идут в направлении возрастания энтропии. Т.о. энтропия указывает направление реальных процессов. Рост энтропии означает все большую недоступность превращения тепла в работу. Максимум энтропии соответствует состоянию равновесия.
Энтропия экстенсивная
величина, она пропорциональна количеству
вещества.
![]() .
.
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Этим свойством так же обладают внутренняя энергия, масса, …. Не обладают этим свойством давление, температура. Физический смысл имеет не сама энтропия, а ее изменение.
Обратимые
адиабатические процессы, для которых
,
характеризуются постоянной энтропией
![]() ,
поэтому их можно назвать изоэнтропийные.
,
поэтому их можно назвать изоэнтропийные.
Энтропия изолированной системы при протекании необратимых процессов возрастает.
Энтропия идеального
газа является функцией
![]() .
.
Выражение для
энтропии - функции состояния одного
моля идеального газа:
![]() ,
где
,
где
![]() - уровень отсчета энтропии.
- уровень отсчета энтропии.
35.Энтропия в обратимых и необратимых процессах.
Расчет энтропии для обратимых процессов. Продифференцируем выражение (15.4) и умножим его на T. Получим следующее равенство:
T·dSm = Cv·dT + R·T·dVm/Vm. (15.6)
Для обратимых процессов справедливо уравнение Менделеева- Клапейрона. Следовательно, из уравнения (15.6) и выражения для расчета теплоемкости при постоянном объеме Cv = dU/dT, получим, что:
T·dSm = dUm + dAm = dQ. (15.7)
В силу аддитивности величин S, V и U уравнение (15.7) справедливо для любой массы газа. Итак,
для любой массы идеального газа при протекании обратимых процессов изменение энтропии равно отношению количества теплоты, сообщенного системе к температуре системы.
.
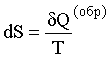 (15.8)
(15.8)
Можно показать, что выражение (15.8) справедливо для любой термодинамической системы (не обязательно идеального газа). Для этого достаточно рассмотреть изолированную термодинамическую систему, находящуюся в равновесии и состоящую из идеального газа и произвольной подсистемы. Пусть температура идеального газа претерпит некоторую флуктуацию dT. Поскольку теплообмена с внешней средой не происходит, то количество теплоты отнятое от идеального газа - dQиг целиком сообщается подсистеме dQподсист. В силу малости dT этот процесс можно считать обратимым. При протекании в изолированной системе обратимого процесса ее энтропия остается постоянной и, следовательно, изменение энтропии будет равно нулю и dSподсист = - dSиг. Причем dSиг = dQиг/T. Поскольку температуры частей системы равны, а изменение энтропии идеального газа подчиняется выражению (15.8), то изменение энтропии подсистемы для обратимых процессов можно рассчитать с помощью выражения, аналогичного (15.8):
dSподсист = - dSиг = - dQиг/dT = dQподсист/T (обр.).
Итак, для обратимых процессов изменение энтропии термодинамической системы рассчитывается с помощью соотношения (15.9).
dS = dQ/T (обр.). (15.9)
Расчет энтропии для необратимых процессов. Состояние, реализуемое относительно малым числом способов называется упорядоченным. Состояние, реализуемое многими различными способами называется беспорядочным или случайным. Исходя из определения энтропии, можно сказать, что ее возрастание ведет к увеличению степени беспорядка системы.
Возрастать энтропия может по двум причинам:
- вследствие необратимого процесса перехода системы в равновесное (более вероятное) состояние;
- вследствие сообщения системе определенного количества теплоты.
Таким образом, для необратимых процессов справедливо следующее неравенство:
dS > dQ/T (необр.). (15.10)
Смысл выражения (15.9) можно трактовать следующим образом. Сообщая определенное количество теплоты системе мы увеличиваем в ней долю беспорядка при данной температуре и, наоборот, увеличивая температуру, мы препятствуем возрастанию беспорядка макросистемы, обуславливаемого сообщаемым ей количеством теплоты.
