
- •33. Эффект Комптона.
- •34. Волны де Бройля.
- •35. Уравнение Шредингера.
- •36.Спектры атомов. Спектры атомов водорода
- •37. Модели атомов (Томсон, Резерфорд).
- •38. Теория атома водорода. Постулаты Бора
- •39. Теория атома водорода. Квантовые числа.
- •40. Фундаментальные взаимодействия и их особенности.
- •41. Элементарные частицы. Классификация элементарных частиц.
- •42. Измерение расстояний во Вселенной.
- •43. Модели строения Вселенной.
- •44. Модели образования Вселенной
- •45. Галактики.
- •46. Звёзды. Эволюция звёзд.
- •47. Классификация звёздных объектов.
- •48. Планетные системы. Солнечная система.
- •49. Строение Земли.
- •50. Системы химических знаний.
- •51. Основные свойства живых организмов
- •52. Теории возникновения жизни на Земле
- •53. Уровни организации живого
36.Спектры атомов. Спектры атомов водорода
АТОМНЫЕ
СПЕКТРЫ - спектры поглощения и испускания
свободных или слабо взаимодействующих
атомов, возникающие при излучательных
квантовых переходах между их уровнями
энергии. А. с. наблюдаются для разреженных
газов или паров и для плазмы. А. с.
линейчатые, т. е. состоят из отд.
спектральных линий, каждая из к-рых
соответствует переходу между двумя
электронными уровнями энергии атома
![]() и
и
![]() и характеризуется значением частоты
и характеризуется значением частоты
![]() поглощаемого и испускаемого эл--магн.
излучения; согласно условию частот Бора
(см. Атомная физика)
поглощаемого и испускаемого эл--магн.
излучения; согласно условию частот Бора
(см. Атомная физика)
![]() . Наряду с частотой, спектральная линия
характеризуется волновым числом
. Наряду с частотой, спектральная линия
характеризуется волновым числом
![]() (с - скорость света) и длиной волны
(с - скорость света) и длиной волны
![]() . Частоты спектральных линий выражают
в с-1, волновые числа - в см-1, длины волн
- в нм и мкм, а также в ангстремах (
. Частоты спектральных линий выражают
в с-1, волновые числа - в см-1, длины волн
- в нм и мкм, а также в ангстремах (![]() ).
В спектроскопии волновые числа также
обозначают буквой
).
В спектроскопии волновые числа также
обозначают буквой
![]() .
Под А. с. в узком
смысле слова понимают оптич. спектры
атомов, т. е. спектры, лежащие в видимой,
близкой ИK- (до неск. нм) и УФ-областях
спектра и соответствующие переходам
между уровнями внеш. электронов с
типичными разностями энергий порядка
неск. эВ (в шкале волновых чисел порядка
десятков тысяч см-1). К А. с. в широком
смысле относятся также и характеристич.
рентгеновские спектры атомов,
соответствующие переходам между уровнями
внутр. электронов атомов с разностями
энергий ~103-104 эВ, и спектры в области
радиочастот, возникающие при переходах
между уровнями тонкой структуры и
сверхтонкой структуры (см. также
Радиоспектроскопия)и при переходах
между очень высокими возбуждёнными
уровнями атомов (такие переходы
наблюдаются методами радиоастрономии).
Атомные спектры
обладают ярко выраженной индивидуальностью:
каждому элементу соответствует свой
спектр нейтрального атома (так называемый
дуговой спектр) и свои спектры
последовательно образующихся положительных
ионов (так называемые искровые спектры).
Линии в этих спектрах обозначают римскими
цифрами, например линии FeI, FeII, FeIII в
спектрах железа соответствуют спектрам
Fe, Fe+, Fe2+
.
Под А. с. в узком
смысле слова понимают оптич. спектры
атомов, т. е. спектры, лежащие в видимой,
близкой ИK- (до неск. нм) и УФ-областях
спектра и соответствующие переходам
между уровнями внеш. электронов с
типичными разностями энергий порядка
неск. эВ (в шкале волновых чисел порядка
десятков тысяч см-1). К А. с. в широком
смысле относятся также и характеристич.
рентгеновские спектры атомов,
соответствующие переходам между уровнями
внутр. электронов атомов с разностями
энергий ~103-104 эВ, и спектры в области
радиочастот, возникающие при переходах
между уровнями тонкой структуры и
сверхтонкой структуры (см. также
Радиоспектроскопия)и при переходах
между очень высокими возбуждёнными
уровнями атомов (такие переходы
наблюдаются методами радиоастрономии).
Атомные спектры
обладают ярко выраженной индивидуальностью:
каждому элементу соответствует свой
спектр нейтрального атома (так называемый
дуговой спектр) и свои спектры
последовательно образующихся положительных
ионов (так называемые искровые спектры).
Линии в этих спектрах обозначают римскими
цифрами, например линии FeI, FeII, FeIII в
спектрах железа соответствуют спектрам
Fe, Fe+, Fe2+
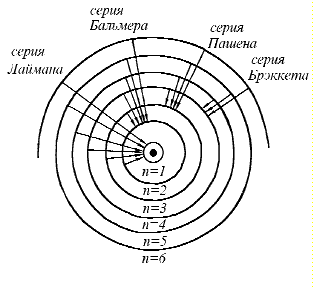
Спектр атома водорода. При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий. В 1885 году Бальмеру удалось найти формулу, описывающую распределение спектральных линий видимого спектра водорода:
![]() если
если
![]() серия
Лаймана
серия
Лаймана
![]() серия
Бальмера
серия
Бальмера
серия Пашена
![]() серия
Брэккета и т.д.
серия
Брэккета и т.д.
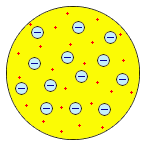
37. Модели атомов (Томсон, Резерфорд).
Согласно первой пудинговой модели, предложенной английским физиком Джозефом Джоном Томсоном, положительный заряд как бы размазан внутри объема атома. В атом как бы вкраплены отдельные электроны, нейтрализующие положительный заряд.
 Резерфорд
предложил ядерную (планетарную) модель
строения атома, в которой атом представлен
в виде миниатюрной Солнечной системы.
Согласно этой модели, весь положительный
заряд и почти вся масса атома (99,4%)
сосредоточены в атомном ядре. Размер
ядра ничтожно мал по сравнению с размером
атома. Вокруг ядра по замкнутым
эллиптическим орбитам движутся электроны,
образуя электронную оболочку атома.
Заряд ядра равен суммарному заряду
электронов.
Резерфорд
предложил ядерную (планетарную) модель
строения атома, в которой атом представлен
в виде миниатюрной Солнечной системы.
Согласно этой модели, весь положительный
заряд и почти вся масса атома (99,4%)
сосредоточены в атомном ядре. Размер
ядра ничтожно мал по сравнению с размером
атома. Вокруг ядра по замкнутым
эллиптическим орбитам движутся электроны,
образуя электронную оболочку атома.
Заряд ядра равен суммарному заряду
электронов.
