
- •1.Классификация соединений по строению углеродной цепи
- •Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются такжеалифатическими.
- •Ковалентные связи углерода
- •4.Классификация и механизмы органических реакций.
- •5.Кинетика органических реакций
- •Рациональная
- •Систематическая июпак
- •Получение циклоалканов
- •7.Углеводороды: физические и химические свойства алканов и циклоалканов. Механизм реакции радикального замещения (sr). Физические свойства
- •Химические свойства
- •8.Углеводороды: строение, номенклатура, изомерия, природные источники и основные методы синтеза алкенов, алкинов и алкадиенов.
- •Методы получения алкенов
- •[Править]Дегидрирование алканов
- •[Править]Дегидрогалогенирование и дегалогенирование алканов
- •[Править]Дегидратация спиртов
- •Физические свойства
[Править]Дегидрогалогенирование и дегалогенирование алканов
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка[15]:
![]()
Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей[16]:
![]()
При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода.
[Править]Дегидратация спиртов
Дегидратацию спиртов ведут при повышенной температуре в присутствии сильных минеральных кислот[15]:
![]()
![]()
Строение алкинов У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях[5]. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже представлены некоторые представители алкинов и их названия:

Методы получения
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
[править]Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
![]()
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
![]()
Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
![]()
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
[править]Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия[15]:
![]()
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Алкадиены
Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Если двойные связи разделены в цепи только одной -связью, то их называют сопряженными. Важнейшие представители сопряженных диенов:
СН2 = СН-СН = СН2 СН2 = С(СН3)-СН = СН2. бутадиен-1,3 изопрен
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется окончанием–диен.
Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия.
Название "дивинил" происходит от названия радикала –СН=СН2 "винил".

Получение
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
![]()
Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
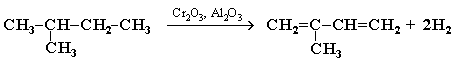
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):

4. Действие спиртового раствора щелочи на дигалогеналканы (дегидрогалогенирование):

9.Углеводороды: физические и химические свойства алкенов, алкинов и алкадиенов. Механизмы реакции электрофильного (АЕ), нуклеофильного (АN) и радикального (AR) присоединения.
Физические свойства алканов
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; после C14H30 — твёрдые вещества.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
