
- •1.Сущность процесса экстракции
- •2. Свойства треугольной диаграммы
- •3. Методы осуществления экстракции
- •4. Однократная экстракция
- •5. Многократная экстракция
- •6. Расчёт противоточной экстракции по ∆-ой диаграмме
- •7. Физическая сущность абсорбции. Уравнение Генри
- •8. Основное уравнение массопередачи при абсорбции.
- •9. Материальный баланс абсорбера.
- •1 0. Тепловой баланс абсорбера.
- •11. Абсорбция тощих газов.
- •12. Коэффициент извлечения абсорбции. Уравнение Кремсена.
- •13.Принципиальная схема установки абсорбер-десорбер.
- •14.Физическая сущность адсорбции
- •15. Изотерма адсорбции
- •16. Скорость адсорбции. Время защитного действия
- •17. Материальный баланс адсорбера.
- •18. Способы регенерации адсорбентов.
- •2 5. Гидродинамические процессы
- •26.Скорость осаждения в поле действия силы тяжести.
- •27.Критериальное уравнение осаждения.
- •28. Сущность процесса фильтрования
- •29. Типы фильтрующих перегородок и осадков
- •30. Способы фильтрования
- •31. Фильтрование при постоянном перепаде давления
- •32. Фильтрование при постоянной скорости.
- •Вопрос 33. Промывка осадка на фильтре.
- •34 Расчет фильтров .
- •Сущность центробежного осаждения и фильтрования
- •36. Центрифуги
- •37. Отстойное центрифугирование. Скорость осаждения при центрифугировании.
- •38. Центробежное фильтрование. Движущая сила.
- •39. Очистка газов в циклонах. Мультициклон. Гидроциклон.
- •40. Основные характеристики псевдоожиженного слоя.
- •41. Основное уравнение гидростатики
- •42.Режимы движения жидкости
- •43.Уравнение неразрывности потока (Материальный баланс потока)
- •44.Энергетический баланс потока жидкости.Ур-е Бернулли.
- •45. Уравнение Дарси-Вейсбаха.
- •46. Истечение жидкости из донного отверстия при постоянном уровне.
- •47. Истечение жидкости из донного отверстия при переменном уровне.
- •48. Местные и линейные гидравлические сопротивления
5. Многократная экстракция
6. Расчёт противоточной экстракции по ∆-ой диаграмме
Чтобы получить рафинатный и экстрактный р-ры требуемого качества при высоком выходе рафинатного р-ра применяют процесс противоточной экстракции.
Для расчета противоточной экстракции должны быть заданы бинодальная кривая с конодами, состав исходного сырья ((∙)F),и состав конечного рафината R3 и (или) экстракта S1. Все остальные величины могут быть определены расчетом.
Уравнения материального баланса для каждой ступени экстракции:
1
ступень
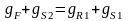 ,
откуда
,
откуда
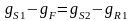
2 ступень откуда
3 ступень откуда
Из приведенных уравнений следует, что
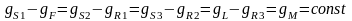

Ур-ние (1) хар-ет пучок прямых, проходящих через (∙) каждой пары встречных потоков S1 и F, S2.и R1, S3 и R2, L и R3 и пересекающихся в (∙)М. Эти линии являются рабочими.
Расход растворителя gL в этом случае определяется координатами (∙)N:
Пусть задан расход растворителя:

К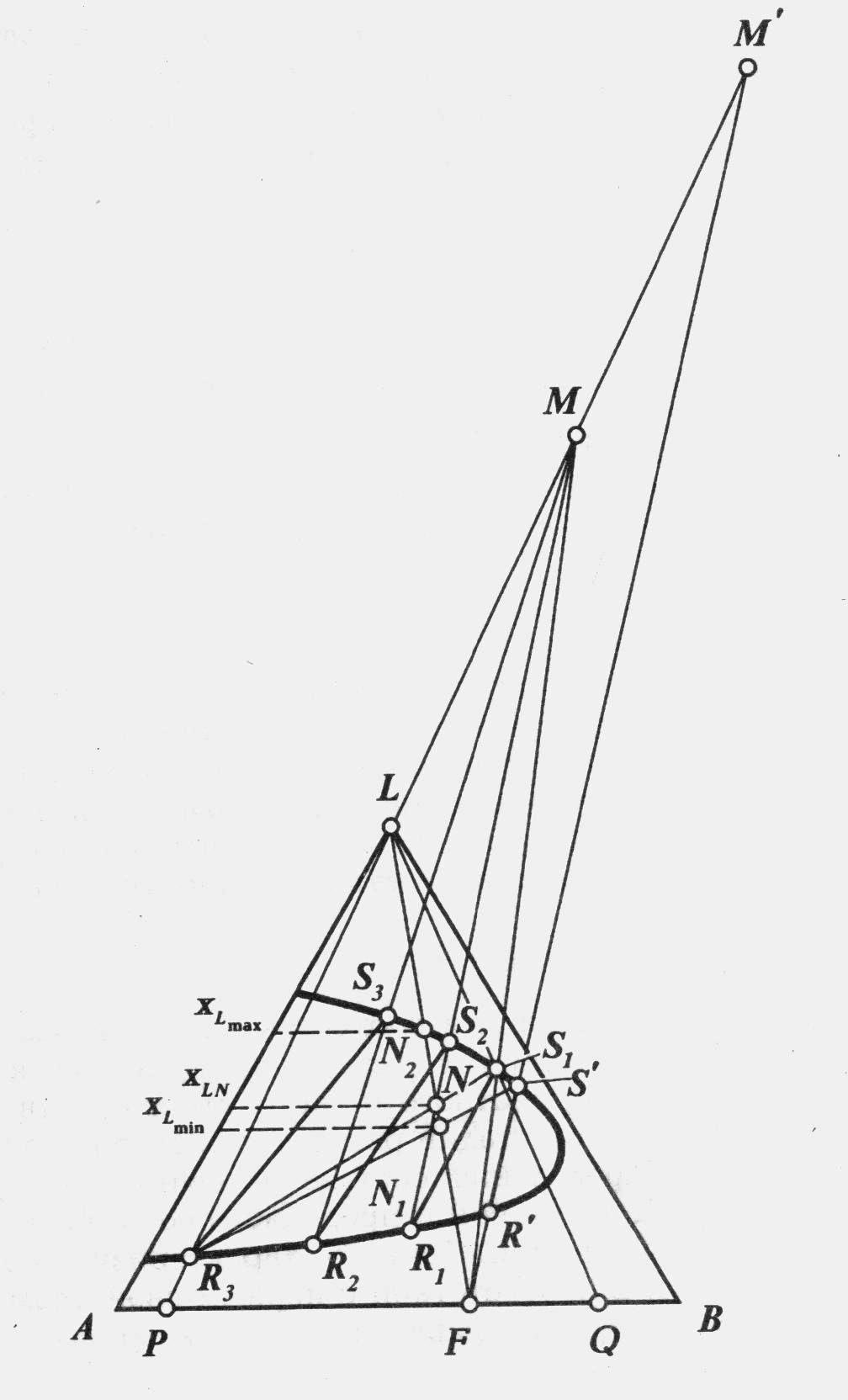 ол-во
конечных рафинатного и экстрактного
р-ров:
ол-во
конечных рафинатного и экстрактного
р-ров:
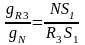 и
и

Выходы рафината
и экстракта:
и

7. Физическая сущность абсорбции. Уравнение Генри
Абсорбция — пр-с избирательного погл-ия комп-тов газовой смеси жидким поглотителем (абсорбентом). Пр-с абсорбции происходит в том случае, когда парц Р извлекаемого комп-та в газовой смеси выше, чем в жидком абсорбенте, вступающем в контакт с этим газом, т.е. для протекания абсорбции необходимо, чтобы газ и абсорбент не находились в состоянии равновесия. Различие в парц Р извлекаемого комп-та в газе и жид-ти является той движущей силой, под действием к-ой происходит поглощение (абсорбция) данного комп-та жидкой фазой из газовой фазы. Чем больше эта движущая сила, тем интенсивнее переходит этот компонент из газовой фазы в жидкую.
Виды абсорбции: физ., при к-ой извлечение комп-тов из газа происходит благодаря их раств-ти в абсорбентах и хим (хемосорбцию), основанную на хим-ом вз-ии извлекаемых комп-тов с активной частью абсорбента. Скорость физ. абсорбции определяется диффузионным пр-сом, скорость хемосорбции зависит от скорости диффузии и химической реакции.
Погл-е комп-ов газовой смеси при абсорбции сопровождается выделением тепла. Процесс абсорбции обратимый, поэтому он используется не только для получения р-ров газов в ж-тях, но и для разделения газовых смесей. При этом после поглощения одного или нескольких комп-ов газа из газовой смеси необходимо произвести выделение из абсорбента поглощенных компонентов т.е. десорбцию.
При выборе абсорбента учитывают состав разделяемого газа, давление и температуру процесса, производительность установки. Выбор абсорбента определяется также его селективностью, поглотительной способностью, коррозионной активностью, стоимостью, токсичностью и другими факторами.
В нефтяной и газовой пром-ти пр-с абсорбции прим-ся для разделения, осушки и очистки УВ газов. Из природных и попутных нефтяных газов путем абсорбции извлекают этан, пропан, бутан и компоненты бензина; абсорбцию применяют для очистки природных газов от кислых компонентов — Н2S, исп-го для производства серы, диоксида углерода, серооксида углерода, сероуглерода, тиолов (меркаптанов) и; с помощью абсорбции также разделяют газы пиролиза и кат.крекинга и осущ-ют санитарную очистку газов от вредных прим. В качестве абсорбентов при разделении УВ газов используют бензиновые или керосиновые фракции, а в последние годы и газовый конденсат, при осушке — диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ). Для абсорбционной очистки газов от кислых комп-ов применяют N-метил-2-пирролидон, гликоли, пропиленкарбонат, трибутилфосфат, метанол; в качестве хим. поглотителя используются моно- и диэтаноламины. В отличие от ректификации пр-с абсорбции протекает в основном однонаправленно. В случае абсорбции многокомпонентной газовой смеси на некоторой ее стадии отдельные комп-ты могут вытесняться другими поглощаемыми комп-тами. В рез-те наряду с пр-сом абсорбции будет протекать пр-с частичной десорбции некоторых комп-ов, что приведет к распределению комп-ов между газовой и жидкой фазами, обусловленному обоими указанными процессами.
Закон Генри справедлив для разбавленных растворов и формулируется следующим образом: парциальное давление компонента прямо пропорционально его мольной концентрации, т.е.
pi = Ki хi'.
