
- •Глава 1.1 Предмет курса. Основные понятия. Классификация дисперсных систем. Методы получения дисперсных систем
- •Глава 1.2 Молекулярно-кинетические свойства дисперсных систем
- •Тема 1.2.1.Броуновское движение
- •Тема 1.2.2. Диффузия
- •Тема 1.2.3. Осмотическое давление
- •Глава 1.3 Оптические свойства и методы исследования дисперсных систем
- •Тема 2.1.1. Термодинамическая характеристика дисперсных систем. Термодинамический метод избыточных величин Гиббса и метод «слоя конечной толщины
- •Тема 2.1.2. Поверхностное натяжение. Методы измерения поверхностного натяжения. Зависимость поверхностного натяжения от температуры и концентрации. Уравнение Шишковского
- •Тема 2.1.3. Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
- •Глава 2.2 Адсорбция
- •Тема 2.2.2. Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции.
- •Тема 2.2.3. Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. Пав. Эффект Ребиндера. Правило Дюкло-Траубе
- •Глава 2.3 Адсорбционные равновесия
- •Тема 2.3.3. Адсорбция на границе «твердое тело – жидкость». Молекулярная адсорбция. Правило выравнивания полярностей Ребиндера
- •Глава 2.4 Адгезия. Когезия. Смачивание и растекание жидкости
- •Тема 2.4.1. Понятие когезии и адгезии. Смачивание и растекание. Работа адгезии и когезии. Уравнение Дюпре. Краевой угол смачивания. Закон Юнга. Гидрофобные и гидрофильные поверхности
- •Тема 2.4.2. Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило Антонова
- •Глава 2.5 Адсорбция ионов на кристалле. Электрокинетические явления
- •Тема 2.5.1. Образование и строение дэс. Электрокинетический потенциал. Правила написания мицелл
- •Тема 2.5.2. Обменная адсорбция. Иониты. Уравнение Никольского
- •Тема 2.5.3. Электрокинетические явления. Электрофорез. Электроосмос. Расчет -потенциала по скорости электрофореза и электроосмоса. Понятие поверхностной проводимости
- •Электроосмос - направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов (рис. 2.5.3.6).
- •Глава 3.1 Стабилизация и коагуляция дисперсных систем
- •Тема 3.1.1. Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
- •Правила коагуляции:
- •Тема 3.1.3. Теория длфо
- •Тема 3.1.4. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
- •При коагуляции смесью электролитов различают два типа процессов:
- •Тема 3.1.5. Седиментация и диффузия. Гипсометрический закон. Седиментационно-диффузионное равновесие. Скорость седиментации
Тема 1.2.2. Диффузия
Диффузией называют самопроизвольное распространение вещества из области с бόльшей концентрацией в область с меньшей концентрацией.
Различают следующие виды диффузии: молекулярную, ионную и коллоидных частиц.
Ионная диффузия связана с самопроизвольным перемещением ионов.
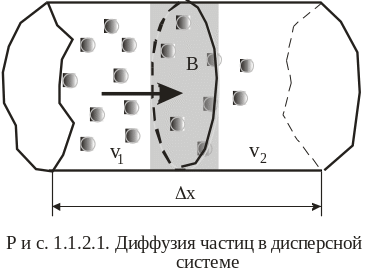 Диффузия
высокодисперсных коллоидных частиц
показана на рис. 1.1.2.1. В нижней части
концентрация частиц больше, чем в
верхней, т.е. v1>v2
(где
Диффузия
высокодисперсных коллоидных частиц
показана на рис. 1.1.2.1. В нижней части
концентрация частиц больше, чем в
верхней, т.е. v1>v2
(где
![]() ,
м3
– численная концентрация частиц, N
– число частиц дисперсной фазы, Vд.с.
– объем дисперсной системы). Диффузия
направлена из области с большей
концентрации в область с меньшей
концентрацией, т.е. слева направо (на
рис. показано стрелкой). Диффузия
характеризуется определенной скоростью
перемещения вещества через поперечное
сечение В,
которая равна
,
м3
– численная концентрация частиц, N
– число частиц дисперсной фазы, Vд.с.
– объем дисперсной системы). Диффузия
направлена из области с большей
концентрации в область с меньшей
концентрацией, т.е. слева направо (на
рис. показано стрелкой). Диффузия
характеризуется определенной скоростью
перемещения вещества через поперечное
сечение В,
которая равна
![]() .
.
На
расстоянии х
разность концентраций составит v2–v1,
т к. v1>v2,
эта величина отрицательна. Изменение
концентрации, отнесенное к единице
расстояния, называют градиентом
концентрации
![]() или
или
![]() .
.
Скорость перемещения вещества пропорциональна градиенту концентрации и площади В, через которую происходит движение диффузионного потока, т.е.
![]() ;
;
![]()
- основное уравнение диффузии в дифференциальной форме
Скорость
диффузии ![]() величина положительная, а градиент
концентрации
величина положительная, а градиент
концентрации
![]() - отрицателен, поэтому перед правой
частью уравнения – знак «минус».
Коэффициент пропорциональности D
– это коэффициент
диффузии.
Основное уравнение справедливо для
всех видов диффузии, в т.ч. и для коллоидных
частиц. В интегральной форме оно применимо
для двух процессов – стационарного и
нестационарного:
- отрицателен, поэтому перед правой
частью уравнения – знак «минус».
Коэффициент пропорциональности D
– это коэффициент
диффузии.
Основное уравнение справедливо для
всех видов диффузии, в т.ч. и для коллоидных
частиц. В интегральной форме оно применимо
для двух процессов – стационарного и
нестационарного:
для стационарного процесса:
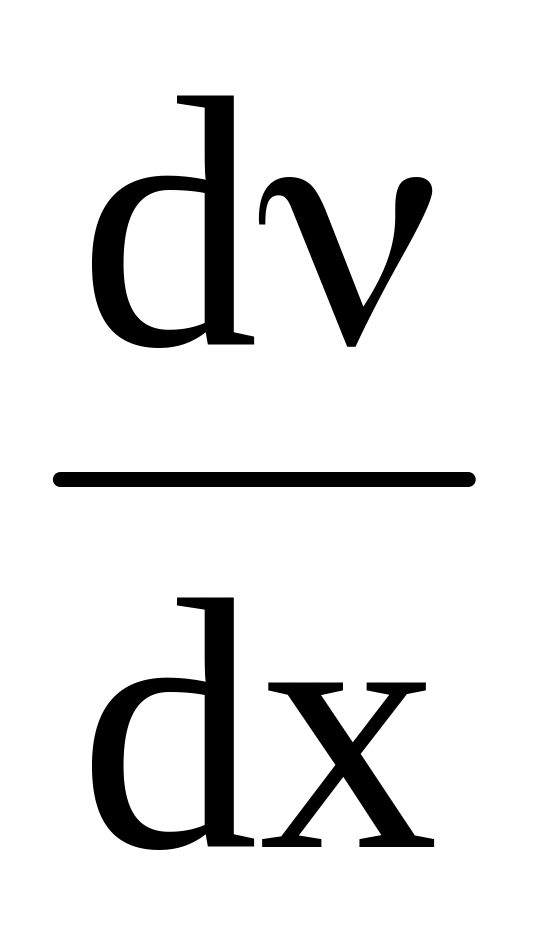 =const.
Значительное число диффузионных
процессов близко к стационарным.
Интегрируя
=const.
Значительное число диффузионных
процессов близко к стационарным.
Интегрируя 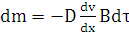 ,
получим:
,
получим:
![]() ;
;
![]() -
закон диффузии Фика
-
закон диффузии Фика
Физический смысл коэффициента диффузии D: если - =1, В = 1 и = 1, то m = D, т.е. коэффициент диффузии численно равен массе диффундирующего вещества, когда градиент концентрации, площадь сечения диффузионного потока и время равны единице. Равенство только численное, т.к. размерность коэффициента диффузии [м2/с] не соответствует размерности массы.
для нестационарного процесса: const. Тогда интегрирование основного уравнения с учетом изменения градиента концентрации усложняется. При отсутствии в среде градиентов температуры, давления, электрического потенциала из уравнения
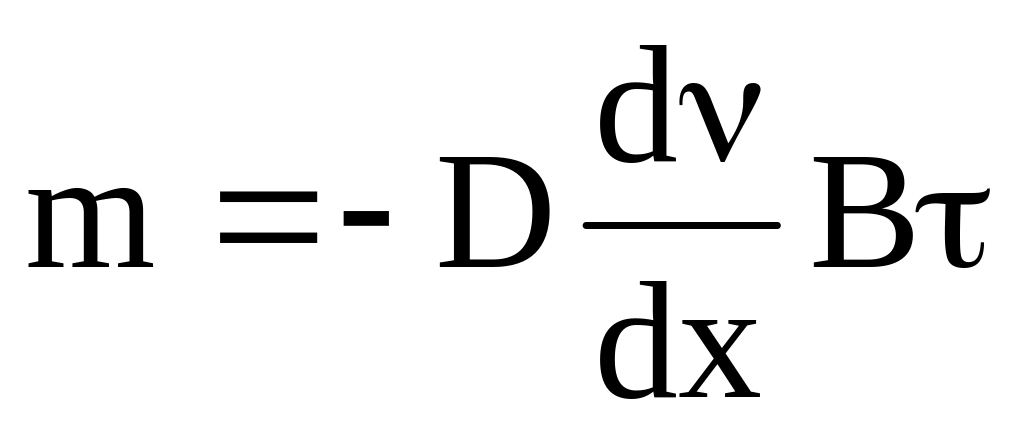 определим массу вещества m1,
переносимого в результате диффузии в
единицу времени через единицу площади
поверхности, перпендикулярной направлению
переноса (В = 1 и
= 1):
определим массу вещества m1,
переносимого в результате диффузии в
единицу времени через единицу площади
поверхности, перпендикулярной направлению
переноса (В = 1 и
= 1):
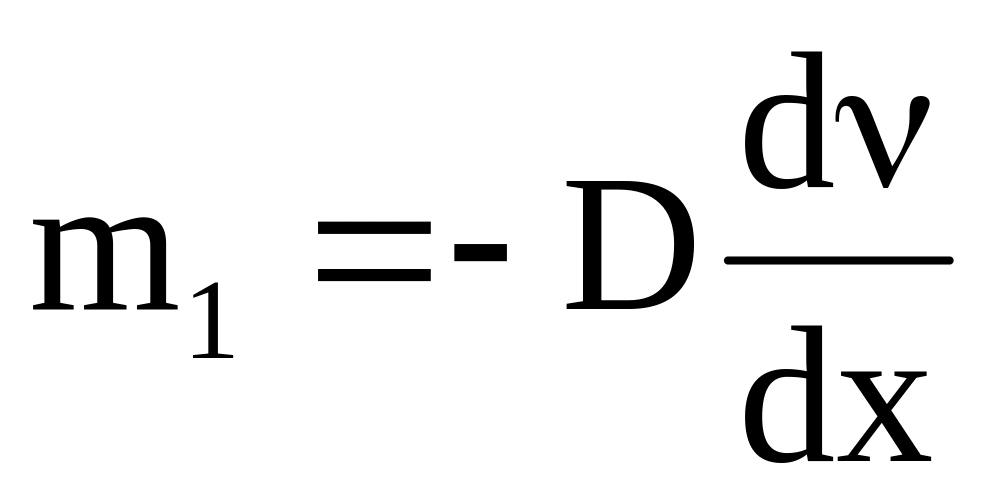 ,
с учетом которого можно определить
пространственно-временное распределение
концентрации:
,
с учетом которого можно определить
пространственно-временное распределение
концентрации:
![]() -
II
закон диффузии Фика
-
II
закон диффузии Фика
На
рис.1.1.2.1 представлена одномерная
диффузия, определяющая движение вещества
в одном направлении. Возможна также
двух- и трехмерная диффузия вещества
(диффузия вещества в двух и трех
направлениях), описываемая уравнением:
![]() ,
где I
– вектор плотности диффузионного
потока; grad
v
– градиент поля концентрации.
,
где I
– вектор плотности диффузионного
потока; grad
v
– градиент поля концентрации.
Для трехмерной диффузии, по второму закону Фика, запишем:
![]() .
.
Для двумерной диффузии в правой части уравнения ограничиваемся выражениями для х и y.
Количественно диффузия определяется коэффициентом диффузии D, связанным со средним сдвигом соотношением:
![]() ;
;
![]() - продолжительность диффузии.
- продолжительность диффузии.
Диффузия высокодисперсных частиц совершается беспорядочно с большей вероятностью в сторону меньшей концентрации. При выводе соотношения приняты следующие допущения:
частицы дисперсной фазы движутся независимо друг от друга,
между частицами отсутствует взаимодействие;
средняя энергия поступательных движений частиц равна 0,5 kT.
Используя
формулу определения среднего сдвига,
коэффициент диффузии можно представить
в виде:
![]() (k
– константа Больцмана, равная
(k
– константа Больцмана, равная
![]() ).
Если D
известен, найдем размер частиц:
).
Если D
известен, найдем размер частиц:
![]() ;
;
![]()
чем больше размер частиц, тем меньше
коэффициент диффузии, менее интенсивна
сама диффузия.
чем больше размер частиц, тем меньше
коэффициент диффузии, менее интенсивна
сама диффузия.
Диффузия
в полной мере проявляется у высокодисперсных
систем (10-9
– 10-7
м), ослаблена у среднедисперсных (10-7
– 10-5
м) и практически отсутствует у
грубодисперсных систем (>10-5
м). Коэффициент диффузии зависит и от
формы частиц, что не учтено в уравнении
![]() .
Поэтому формула
.
Поэтому формула
![]() определяет
размер только коллоидных шарообразных
частиц (или приведенный к шарообразному
размер частиц неправильной формы). [2]
определяет
размер только коллоидных шарообразных
частиц (или приведенный к шарообразному
размер частиц неправильной формы). [2]
