
- •Глава 1.1 Предмет курса. Основные понятия. Классификация дисперсных систем. Методы получения дисперсных систем
- •Глава 1.2 Молекулярно-кинетические свойства дисперсных систем
- •Тема 1.2.1.Броуновское движение
- •Тема 1.2.2. Диффузия
- •Тема 1.2.3. Осмотическое давление
- •Глава 1.3 Оптические свойства и методы исследования дисперсных систем
- •Тема 2.1.1. Термодинамическая характеристика дисперсных систем. Термодинамический метод избыточных величин Гиббса и метод «слоя конечной толщины
- •Тема 2.1.2. Поверхностное натяжение. Методы измерения поверхностного натяжения. Зависимость поверхностного натяжения от температуры и концентрации. Уравнение Шишковского
- •Тема 2.1.3. Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
- •Глава 2.2 Адсорбция
- •Тема 2.2.2. Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции.
- •Тема 2.2.3. Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. Пав. Эффект Ребиндера. Правило Дюкло-Траубе
- •Глава 2.3 Адсорбционные равновесия
- •Тема 2.3.3. Адсорбция на границе «твердое тело – жидкость». Молекулярная адсорбция. Правило выравнивания полярностей Ребиндера
- •Глава 2.4 Адгезия. Когезия. Смачивание и растекание жидкости
- •Тема 2.4.1. Понятие когезии и адгезии. Смачивание и растекание. Работа адгезии и когезии. Уравнение Дюпре. Краевой угол смачивания. Закон Юнга. Гидрофобные и гидрофильные поверхности
- •Тема 2.4.2. Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило Антонова
- •Глава 2.5 Адсорбция ионов на кристалле. Электрокинетические явления
- •Тема 2.5.1. Образование и строение дэс. Электрокинетический потенциал. Правила написания мицелл
- •Тема 2.5.2. Обменная адсорбция. Иониты. Уравнение Никольского
- •Тема 2.5.3. Электрокинетические явления. Электрофорез. Электроосмос. Расчет -потенциала по скорости электрофореза и электроосмоса. Понятие поверхностной проводимости
- •Электроосмос - направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов (рис. 2.5.3.6).
- •Глава 3.1 Стабилизация и коагуляция дисперсных систем
- •Тема 3.1.1. Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
- •Правила коагуляции:
- •Тема 3.1.3. Теория длфо
- •Тема 3.1.4. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
- •При коагуляции смесью электролитов различают два типа процессов:
- •Тема 3.1.5. Седиментация и диффузия. Гипсометрический закон. Седиментационно-диффузионное равновесие. Скорость седиментации
Тема 2.5.2. Обменная адсорбция. Иониты. Уравнение Никольского
И онообменная
адсорбция из растворов наблюдается на
поверхности с достаточно выраженным
двойным электрическим слоем (ДЭС).
Вещества, проявляющие способность к
ионному обмену и используемые для
адсорбции ионов, получили название
ионообменников или ионитов.
Иониты имеют структуру в виде каркаса,
«сшитого» обычно ковалентными связями.
Каркас (матрица) обладает положительным
или отрицательным зарядом (рис. 2.5.2.1),
который скомпенсирован противоположными
зарядами подвижных ионов, т.е. противоионов,
находящихся в адсорбционной и диффузионных
частях двойного электрического слоя
(ДЭС). Противоионы могут заменяться на
другие ионы с зарядом того же знака.
Каркас выступает в роли полииона и
обуславливает нерастворимость ионита
в растворителе. Основными свойствами
ионитов, определяющими их качество как
сорбентов, являются емкость,
кислотно-основные
свойства,
селективность,
набухаемость,
химическая стойкость, механическая
прочность.
онообменная
адсорбция из растворов наблюдается на
поверхности с достаточно выраженным
двойным электрическим слоем (ДЭС).
Вещества, проявляющие способность к
ионному обмену и используемые для
адсорбции ионов, получили название
ионообменников или ионитов.
Иониты имеют структуру в виде каркаса,
«сшитого» обычно ковалентными связями.
Каркас (матрица) обладает положительным
или отрицательным зарядом (рис. 2.5.2.1),
который скомпенсирован противоположными
зарядами подвижных ионов, т.е. противоионов,
находящихся в адсорбционной и диффузионных
частях двойного электрического слоя
(ДЭС). Противоионы могут заменяться на
другие ионы с зарядом того же знака.
Каркас выступает в роли полииона и
обуславливает нерастворимость ионита
в растворителе. Основными свойствами
ионитов, определяющими их качество как
сорбентов, являются емкость,
кислотно-основные
свойства,
селективность,
набухаемость,
химическая стойкость, механическая
прочность.
Емкость - способность ионита обменивать противоионы.
Ёмкость определяется числом ионогенных групп в ионите и поэтому теоретически она постоянна. Однако практически она зависит от ряда условий. Различают такие виды емкости:
- статистическая обменная емкость (СОЕ)
- динамическая обменная емкость (ДОЕ)
Статическая обменная емкость (СОЕ) – это полная емкость, характеризующая общее число ионогенных групп в миллиэквивалентах, приходящихся на единицу массы воздушно-сухого ионита или единицу объема набухшего ионита.
Динамическая обменная емкость (ДОЕ) - относится только к тем ионогенным группам, которые используются в технологических процессах (ионообменные колонны) при относительном движении ионита и раствора.
Ионит, обменивающийся ионами Н+ на катионы, называется катионитом, а ионит, обменивающий ОН- на анион, называется анионитом.
Ионообменное равновесие - равновесие, установившееся по истечении некоторого времени в ионите между концентрациями ионов и раствора электролита.
Ионообменную реакцию можно представить уравнением
![]() ,
,
где Z1, Z2 - заряды обменивающихся ионов М1 и М2.
Константа равновесия этой реакции называется константой ионного обмена.
 .
.
Все
показатели с черточкой относятся к
иониту, без черточки - к раствору. Возведя
правую и левую части уравнения в степень
![]() ,
,
получим 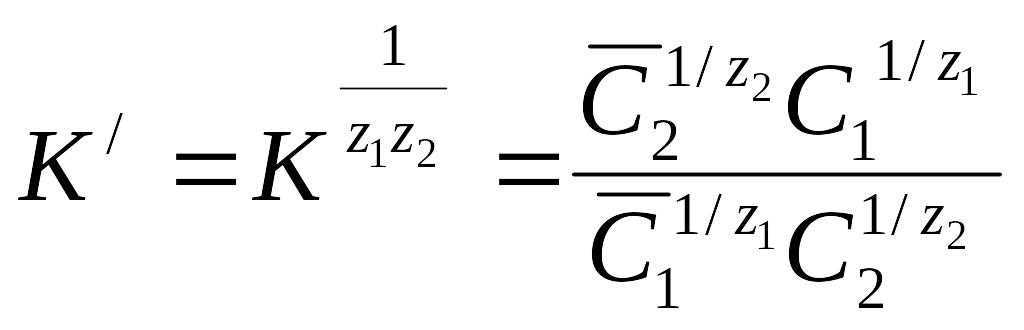 -
уравнение
Никольского.
-
уравнение
Никольского.
Для данного иона К’ отражает свойства обменивающихся ионов и характеризует их относительное сродство к иониту, т.е. селективность ионита по отношению к тому или иному иону. Если заряды обменивающихся ионов одинаково постоянны, то в уравнении это выражается коэффициентом разделения. Селективность зависит от многих факторов. Сетка матрицы сопротивляется набуханию, поэтому ионит предпочтительней поглощает менее гидратированный ион. Этот факт объясняет установленный для катионитов лиотропные ряды сорбируемости. Например, однозарядные катионы имеют ряд Li+ < Na+ < K+ < Rb+ < Cs+.
Повышение жесткости матрицы достигается повышенным содержанием мостикообразователя и приводит к повышению селективности ионита по отношению к ионам большего размера в гидратированных состояниях. Если ионы имеют разные заряды, то действует правило электроселективности, в соответствии с которым из разбавленных растворов ионит предпочитает поглощать противоионы с меньшим зарядом. Селективность зависит и от формы иона в растворе. Чем меньше их активность, тем хуже они сорбируются. Сорбируемость элементов высока, если они находятся в соответствующей ионной форме. Решающее влияние на селективность оказывает специфическое (химическое) сродство противоионов к иониту. Чем более прочную пару образует фиксированный ион (на матрице) с противоположным (чем больше химическое сродство), тем больше селективность электролита (ионита). Например, слабокислые катионы имеют специфическое сродство с Н+-ионами и поэтому сорбируют их сильнее, чем ионы щелочных металлов. Ионный обмен можно представить в виде изотермы адсорбции первого или второго иона. Вывод уравнения аналогичен выводу уравнения молекулярного обмена. Разница в том, что для изотермы ионного обмена концентрацию необходимо брать в эквивалентных долях:
![]()
![]()
![]()
После подстановки эквивалентных долей в уравнение для константы ионного обмена получим
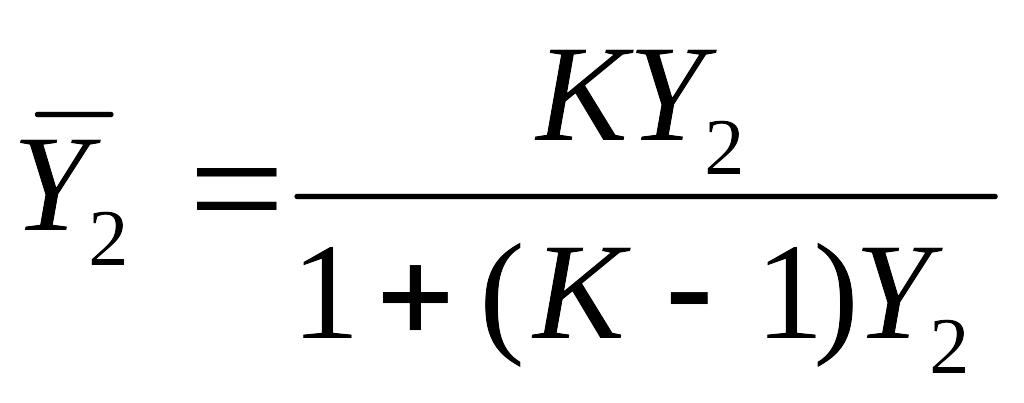
Ионный обмен используется в промышленности для разделения продукта очистки сточных вод и как метод анализа.
