
- •Лекция №1 Введение
- •Лекция №2
- •Равновесие химико-технологических процессов.
- •Количественная оценка смещения равновесия.
- •Лекция №3 Кинетика химических реакций
- •Скорость необратимых реакций
- •Обратимые реакции
- •Лекция №4 Определение оптимальной и равновесной температур для обратимых реакций.
- •Определение оптимальной температуры.
- •2. Определение равновесной температуры.
- •Управление скоростью реакции, протекающей по законам формальной кинетики.
- •Лекция №5
- •Управление состоянием равновесия и скоростью сложных процессов.
- •Влияние температуры, давления и концентрации на скорость параллельных реакций.
- •Лекция №6 Моделирование химического реактора.
- •Лекция №7 Реакторы
- •Модель реактора идеального вытеснения
- •Модель реактора полного смешения
- •Лекция №8
- •Рассматриваем экзотермическую реакцию.
- •Лекция №9 Адиабатический температурный режим.
- •Тепловой эффект химической реакции.
- •Лекция №10 Сравнение адиабатических реакторов при проведении эндотермической реакции.
- •С равнение реакторов при проведении экзотермической реакции.
- •Лекция №11 Оптимизация работы единичного реактора по экономическим критериям
- •Лекция № 11 Гетерогенные процессы.
- •Лекция №12 Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Внутренняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Кинетическая область протекания гетерогенного процесса в системе газ/твердое вещество.
Лекция №5
В основе метанольных топливных элементов лежит реакция:
СН3ОН = СО + 2Н2

CO тормозит реакцию, так как находится в адсорбированном состоянии на катализаторе и неохотно его покидает. Это уравнение каталитической реакции.
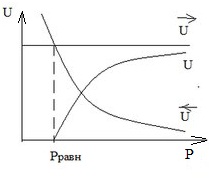
Проанализируем, как будет зависеть скорость процесса от давления, при Т=const и ХСН3ОН=const. Для этого применим закон Дальтона:

Получаем, что скорость прямой реакции не зависит от давления, а скорость обратной реакции зависит от давления линейно.

В ычитая из U, U получаем, что для этой реакции наблюдаемая скорость уменьшается с ростом давления.
Таким образом, для данной реакции отсутствует понятие Ропт, а любое увеличение давления, выше атмосферного, приведет к снижению скорости. Отталкиваться нужно от Ратм.
Управление состоянием равновесия и скоростью сложных процессов.
Рассмотрим случай протекания параллельных реакций.
а1А + b1B = cC
a2A + b2B = dD
Для расчета равновесного состава реакционной смеси необходимо составить материальный баланс и установить связь между начальными мольными долями компонентов и равновесной степени превращения ключевого компонента в каждой реакции.
Для упрощения задачи примем, что суммарный мольный поток NNS = 1 моль/с, соответственно, мольные потоки исходных реагентов численно равны начальным мольным долям этих реагентов, а для упрощения таблицы примем, что мольные доли продуктов в исходной смеси равны 0.
Соответственно, производительность по компоненту А будет равна:
|
а1А + b1B = cC a2A + b2B = dD |
|
|||
исх |
ZNA |
ZNB |
0 |
|
1 |
пр-х |
|
|
|
0 |
|
|
|
0 |
|
|
|
ком |
|
ZNB-b1/a1·ZNA·X1- b2/a2·ZNA·X2 |
|
|
W |

Для расчета мольных долей компонентов конечной смеси надо разделить мольный поток каждого компонента на коэффициент изменения числа молей.
Для расчета равновесного состава составляем 2 функции.


И для нахождения величин Х1 и Х2 необходимо решать систему 2х этих трансцендентных уравнений, при этом помнить, что Х1, Х2 0 ≤ Х1+Х2 ≥ 1.
Попробуем проанализировать, как будет изменяться равновесный состав.
Экзотермическая реакция.

Kp1 больше, чем Kp2, отсюда мы можем сделать вывод, что для выполнения Х1+Х2=1 необходимо, чтобы равновесная концентрации компонента С была больше, чем концентрация компонента D.
Эндотермическая реакция.


Влияние температуры, давления и концентрации на скорость параллельных реакций.
Скорость химической реакции зависит от большого числа различных факторов. Для сложных реакции, в частности для параллельных, вопрос о выборе концентраций реагентов для управления процессом не является однозначным. Рассмотрим для примера систему из двух параллельных реакций разного порядка (при постоянной температуре):

(II)
 .
.
Говоря об увеличении скорости такой реакции, нужно сначала решить, какая реакция более важна, т.е. какая реакция приводит к образованию нужного целевого продукта. Нас интересует чаще всего не то, насколько быстро израсходуется реагент А, а насколько быстрее целевой продукт будет образовываться но сравнению с побочным продуктом. Пусть в рассматриваемом примере целевым является продукт первой реакции R, а побочным - продукт S.
Для анализа соотношения скоростей целевого и побочных процессов пользуются мгновенной или дифференциальной селективностью, равной отношению скорости расходования реагента А на целевую реакцию к общей скорости расходования реагента и на целевую, и на побочные реакции. Значение дифференциальной селективности в ходе процесса в общем случае не остается постоянным, гак как оно определяется отношением скоростей реакций, а скорость реакции по мере ее протекания меняется. Лишь в том случае, когда параметры процесса во времени и пространстве не меняются, φ’остается постоянной величиной.
При протекании химической реакции меняются концентрации реагентов и продуктов. Рассмотрим, как при изменении концентрации исходного реагента А для системы параллельных реакций (II) при постоянной температуре процесса меняется дифференциальная селективность φ’. Пусть целевая реакция имеет по исходному реагенту порядок n1, а побочная реакция – n2, тогда:



Проанализируем зависимость φ’ от концентрации реагента А. Для удобства преобразуем выражение:

Очевидно, что φ’ может быть как возрастающей, так и убывающей функцией от концентрации. Определим характер функции φ’(сА) по знаку первой производной:

Как видно из этого уравнения, знак первой производной зависит от знака Δn. Если Δn<0, т.е. если n1>n2, то φ’(сА) – возрастающая функция. Скорость целевой реакции с ростом концентрации исходного реагента возрастает значительно быстрее скорости побочной реакции и доля скорости целевой реакции в суммарной скорости возрастает.
В этом случае желаемый результат – увеличение скорости образования целевого продукта R по сравнению со скоростью образования побочного продукта S – достигается при использовании исходного реагента высокой концентрации.
При Δn>0 характер зависимости противоположный, следовательно, φ’(сА) – убывающая функция. И более высокая концентрация достигается при низкой концентрации исходного реагента.
При Δn=0 дифференциальная селективность остается постоянной величиной при любых значениях исходных реагентов, и изменить φ’ можно только изменив соотношение к2/к1.
Проще всего можно повлиять на это соотношение изменив температуру проведения реакции, так как температура является одним из параметров, в наибольшей степени влияющим на скорость реакции. Рассмотрим влияние температуры, анализируя уравнение Аррениуса:
 .
.
Можно
пренебречь зависимостью предэкспоненциального
множителя от температуры (RT<<Е).
Уравнение Аррениуса можно представить
в виде линейной зависимости:
 .
Из анализа этой зависимости можно
сделать следующие выводы:
.
Из анализа этой зависимости можно
сделать следующие выводы:
1) Из неравномерности температурной шкалы следует, что химические реакции более чувствительны к изменениям температуры в области более низких температур.
2) Чем выше энергия активации реакции, тем более чувствительна она к изменениям температуры.
3) Рассмотрим влияние температуры на дифференциальную селективность параллельных реакций:

Для того, чтобы выделить только влияние температуры на селективность, принимаем, что n1=n2. Преобразуем это уравнение с учетом уравнения Аррениуса.

Пренебрегая
слабым влиянием температуры на
предэкспоненциальные множители в
уравнении Аррениуса, считаем, что
 от температуры не зависит. Тогда
производная
от температуры не зависит. Тогда
производная
 положительна, если ΔЕ=Е1-Е2>0,
и отрицательна, если ΔЕ<0.
положительна, если ΔЕ=Е1-Е2>0,
и отрицательна, если ΔЕ<0.
Таким образом, если энергия активации целевой реакции превышает энергию активации побочной реакции, то с ростом температуры наблюдается возрастание дифференциальной селективности, т.е. относительно более быстрое увеличение скорости целевой реакции по сравнению с ростом скорости побочной реакции и суммарной скорости процесса. И наоборот, если Е1<Е2, для увеличения дифференциальной селективности φ’ нужно понижать, а не повышать температуру.
Задачи

Р, ННСl=const
Р
 ,
ННСl=const
,
ННСl=const


Экзотермическая реакция
T, P = const
T
 V
VP












