
- •Лекция №1 Введение
- •Лекция №2
- •Равновесие химико-технологических процессов.
- •Количественная оценка смещения равновесия.
- •Лекция №3 Кинетика химических реакций
- •Скорость необратимых реакций
- •Обратимые реакции
- •Лекция №4 Определение оптимальной и равновесной температур для обратимых реакций.
- •Определение оптимальной температуры.
- •2. Определение равновесной температуры.
- •Управление скоростью реакции, протекающей по законам формальной кинетики.
- •Лекция №5
- •Управление состоянием равновесия и скоростью сложных процессов.
- •Влияние температуры, давления и концентрации на скорость параллельных реакций.
- •Лекция №6 Моделирование химического реактора.
- •Лекция №7 Реакторы
- •Модель реактора идеального вытеснения
- •Модель реактора полного смешения
- •Лекция №8
- •Рассматриваем экзотермическую реакцию.
- •Лекция №9 Адиабатический температурный режим.
- •Тепловой эффект химической реакции.
- •Лекция №10 Сравнение адиабатических реакторов при проведении эндотермической реакции.
- •С равнение реакторов при проведении экзотермической реакции.
- •Лекция №11 Оптимизация работы единичного реактора по экономическим критериям
- •Лекция № 11 Гетерогенные процессы.
- •Лекция №12 Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Внутренняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Кинетическая область протекания гетерогенного процесса в системе газ/твердое вещество.
Лекция №3 Кинетика химических реакций
Рассмотрим реакцию: aA + bB = cC +dD

где
 скорость химической реакции, кмоль/м3∙с;
скорость химической реакции, кмоль/м3∙с;
Скорость численно равна изменению числа молей ключевого реагента в единицу времени в единице реакционного объёма.

Таким образом, скорость позволяет определить время химической реакции.
Скорость
химической реакции пропорциональна
движущей силе химической реакции
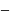 произведение концентраций исходных
реагентов. В растворе:
произведение концентраций исходных
реагентов. В растворе:

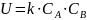 ,
уравнение Аррениуса.
,
уравнение Аррениуса.
Формальная кинетика основывается на том, что скорость пропорциональна концентрации, а показатели будут являться коэффициентами. В истинной кинетике считается, что любая химическая реакция многостадийна.
Например,

 сорбция
(молекула на поверхности катализатора)
сорбция
(молекула на поверхности катализатора)
…………………….. и т.д.
Просуммировав все стадии, придём к исходному уравнению. Самая медленная стадия первая, поэтому она и определяет скорость химической реакции.
Истинная кинетика определяет механизм реакции, и уравнения истинной кинетики отличаются от уравнений формальной.
Формальная
кинетика:

Истинная
кинетика:

Зависимость
 имеет вид:
имеет вид:
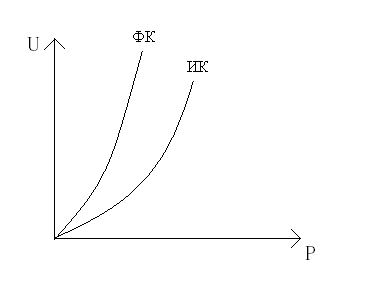

[AB*]
E1
E2
eA+eB
eC+eB
-ΔH0
уравнениеАррениуса;
где
 предэкспоненциальный множитель
предэкспоненциальный множитель показывает
вероятность протекания химической
реакции; Е
энергия активации;
показывает
вероятность протекания химической
реакции; Е
энергия активации;
где [AB*] промежуточный комплекс;
Е тот избыток энергии, который необходимо преодолеть реагирующим молекулам, чтобы произошла химическая реакция, кДж/кмоль;

 т.д.
приведённые концентрации и давления
т.д.
приведённые концентрации и давления
Если Е2 > Е1 , то реакция экзотермическая, а если Е2 < Е1 , то реакция эндотермическая.
Кинетическое
уравнение имеет параметры: Е,
 и показатели при концентрации в одном
веществе, другом веществе или суммарно
(порядок реакции по одному или другому
компоненту или суммарно).
и показатели при концентрации в одном
веществе, другом веществе или суммарно
(порядок реакции по одному или другому
компоненту или суммарно).
Скорость необратимых реакций
Выражение для скорости имеет вид:
движущая сила


где
 степень
превращения;
степень
превращения;
Скорость реакции зависит от нескольких параметров:

Проанализируем зависимость скорости от различных параметров:

Увеличивается Т → увеличивается кинетическая энергия → увеличивается скорость U
2)

P1
P2
3)

Уменьшается движущая сила → уменьшается скорость U
Увеличивается Х → уменьшается концентрация действующих реагентов → скорость U уменьшается
U

P=const
1
T2
T3
T1
X1
T

XA
T3
T2
T1
1
Обратимые реакции

где
 1
скорость прямой реакции;
1
скорость прямой реакции;
2 скорость обратной реакции;
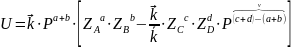
 коэффициент
изменения числа молей
коэффициент
изменения числа молей

где ДС движущая сила;
Выразим
 .
Тогда формула для скорости примет вид:
.
Тогда формула для скорости примет вид:

Константу равновесия можно выразить через энергию Гиббса:


 >0
для эндотермических реакций ,
>0
для эндотермических реакций ,
 0
для
экзотермической.
0
для
экзотермической.
Рассмотрим случаи:
Если >0:

 равновесная
температура (
=0);
равновесная
температура (
=0);
Причина увеличения скорости для эндотермической реакции: движущая силы увеличивается, константа скорости химической реакции также увеличивается.
Если <0:

равновесная температура ( =0);
Для экзотермической реакции: скорость увеличивается, так как с ростом температуры возрастание константы скорости опережает снижение движущей силы. Затем скорость уменьшается, так как преобладает снижение движущей силы. Этим объясняется наличие экстремума.
Т и XA = const




 равновесное
давление (
=0);
равновесное
давление (
=0);
При увеличении давления возрастает величина Рa+b, следовательно увеличивается скорость реакции. С увеличением давления движущая сила химической реакции уменьшается, скорость реакции уменьшается.


В этом случае скорость увеличивается, т.к увеличивается движущая сила


Скорость увеличивается, так как возрастает величина Рa+b. Таким образом, с увеличением давления скорость реакции всегда увеличивается.
Т и XA = const


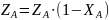
 равновесная
степень превращения (
=0);
равновесная
степень превращения (
=0);
С увеличением степени превращения скорость реакции уменьшается, так как уменьшается движущая сила (или уменьшается концентрация реагента). При достижении равновесия скорость равна 0.

