
- •Лекция №1 Введение
- •Лекция №2
- •Равновесие химико-технологических процессов.
- •Количественная оценка смещения равновесия.
- •Лекция №3 Кинетика химических реакций
- •Скорость необратимых реакций
- •Обратимые реакции
- •Лекция №4 Определение оптимальной и равновесной температур для обратимых реакций.
- •Определение оптимальной температуры.
- •2. Определение равновесной температуры.
- •Управление скоростью реакции, протекающей по законам формальной кинетики.
- •Лекция №5
- •Управление состоянием равновесия и скоростью сложных процессов.
- •Влияние температуры, давления и концентрации на скорость параллельных реакций.
- •Лекция №6 Моделирование химического реактора.
- •Лекция №7 Реакторы
- •Модель реактора идеального вытеснения
- •Модель реактора полного смешения
- •Лекция №8
- •Рассматриваем экзотермическую реакцию.
- •Лекция №9 Адиабатический температурный режим.
- •Тепловой эффект химической реакции.
- •Лекция №10 Сравнение адиабатических реакторов при проведении эндотермической реакции.
- •С равнение реакторов при проведении экзотермической реакции.
- •Лекция №11 Оптимизация работы единичного реактора по экономическим критериям
- •Лекция № 11 Гетерогенные процессы.
- •Лекция №12 Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Внутренняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Кинетическая область протекания гетерогенного процесса в системе газ/твердое вещество.
Лекция № 11 Гетерогенные процессы.
К гетерогенным процессам относятся процессы в системах: газ – твёрдое вещество, газ – жидкость, жидкость – твёрдое вещество, твёрдое – твёрдое, жидкость – жидкость (если жидкости несмешивающиеся), газофазные процессы при участии твёрдых катализаторов.
Отличительной особенностью любого гетерогенного процесса является наличие поверхности раздела фаз, которая может быть постоянной, либо меняться во времени. При протекании гетегогенного процесса наряду с чисто химическими стадиями существуют диффузионные стадии. Поэтому для управления гетерогенным процессом важна идентификация лимитирующей стадии.
В общем случае для идентификации лимитирующей стадии исследуют зависимость скорости реакции от температуры, и на этой зависимости можно выделить три области:
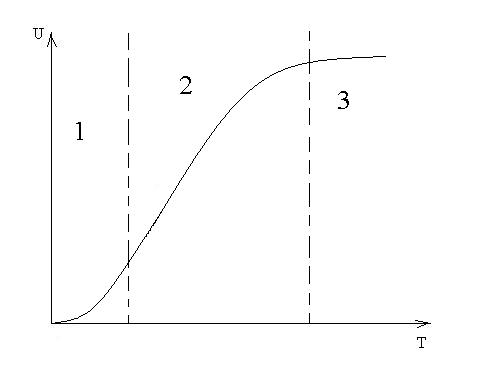
1 – скорость возрастает с увеличением температуры, и выполняется закон Аррениуса. Это кинетическая область протекания процесса. Управляющими будут микрокинетические факторы (температура, давление, концентрации).
3
– скорость процесса практически не
зависит от температуры. Диффузионная
область энергии активации и диффузии
очень мала, следовательно, изменение
температуры не приводит к изменению
коэффициента диффузии, и скорость
изменяется несущественно. Управляющими
являются макрокинетическими параметры,
связанные со скоростью подачи реагентов,
степенью перемешивания реагентов,
степенью диспергирования реагентов.
Также в этой области в соответствии со
скоростью диффузии по первому закону
Фика управляющей является концентрация
реагентов:
 .
Отличительный признак диффузионной
области: первый порядок реакции по
компоненту независимо от молекулярности
реакции.
.
Отличительный признак диффузионной
области: первый порядок реакции по
компоненту независимо от молекулярности
реакции.
2 – переходная область. Скорость увеличивается с увеличением температуры, но закон Аррениуса не выполняется. В этой области управляющими являются и микро- , и макрокинетические факторы, но интенсивность их воздействия на процесс меньше, чем в соответствующей области протекания.
С точки зрения промышленной реализации область 2 наименее перспективна, но следует учитывать, что по ходу гетерогенного процесса он может переходить из одной области в другую. Поэтому для предотвращения перехода изменение одного из микрокинетических параметров обычно сопровождают изменением какого-либо макрокинетического параметра.
Гетерогенный процесс – это процесс многостадийный. Наиболее простыми являются процессы в системе жидкость – газ, которые обычно протекают в три стадии:
1-я стадия: область внешней диффузии, то есть подвод газа и жидкости к поверхности раздела фаз, которая чаще всего формируется искусственно (насадочная колонна).
2-я стадия: химическое взаимодействие. Кинетическая область.
3-я стадия: отвод продуктов от поверхности раздела фаз. Внешняя диффузионная область протекания процесса.
В подавляющем большинстве случаев процессы в системе жидкость – газ протекают во внешней диффузионной область, поэтому при проектировании оборудования необходимо решать проблему одновременного увеличения линейной скорости подачи реагентов и увеличение площади поверхности насадки. Для того чтобы создать требуемую поверхность контакта фаз необходимо уменьшать размер элементов насадки, что приводит к увеличению гидравлического сопротивления при увеличении скорости подачи реагентов. Следовательно, необходимо искать оптимум в этом вопросе.
При проведении адсорбции температура не является управляющим параметром, так как при увеличении температуры растворимость газа в жидкости уменьшается, и увеличение температуры начинают только в том случае, если общая скорость абсорбции лимитируется химической реакцией.
Наибольшую сложность для рассмотрения представляют процессы в системе газ – твёрдое вещество. В общем случае процесс можно представить как совокупность 11 стадий:
1-я стадия: диффузия газообразного реагента к поверхности твёрдой частицы (внешняя диффузия).
2-я стадия: диффузия газообразного реагента через слой продукта к поверхности раздела фаз (внутренняя диффузия).
3-я стадия: адсорбция газообразного реагента на поверхности раздела фаз.
4-я стадия: растворение газообразного реагента в твёрдом непрореагировавшем исходном веществе.
5-я стадия: диффузия от поверхности раздела фаз к потенциальному центру образования ядра новой фазы.
6-я стадия: химическая реакция.
Далее в обратной последовательности (5-я, 4-я, 3-я, 2-я, 1-я расшифровать).
Все 11 стадий наблюдаются в том случае, если уравнение реакции имеет вид: Атв + Вгаз = Ств + Dгаз.
Если же: Атв = Ств + Dгаз , то шесть стадий, начиная от химической реакции (с 6-ой по 11-ю).
Если: Атв + Вгаз = Ств , то шесть стадий, начиная с диффузии газообразного реагента к поверхности твёрдой частицы (с 1-ой по 6-ю).
Для описания кинетики твёрдофазного взаимодействия используется три основные модели образования ядер новой фазы.
Первая модель.
Образование ядер новой фазы происходит с одинаковой вероятностью на всей внешней поверхности твёрдой частицы при реализации физических условий процесса. Такая модель может быть применена при рассмотрении процессов разложения твёрдого материала, если температура процесса выше, чем температура начала разложения. В этом случае при реализации физических условий процесса вся поверхность твёрдой частицы покрывается слоем продукта, и дальнейшее продвижение к поверхности раздела фаз обуславливается только диффузионными сопротивлениями, обусловленными как пористостью материала, так и размером твёрдых частиц.
Вторая модель.
Образование ядер новой фазы на активных центрах происходит с одинаковой вероятностью. В качестве активных центров рассматривают дефекты кристаллической решётки твёрдого материала и включения микропримесей, которые обязательно присутствуют в материале. Согласно этой модели считается, что активные центры равномерно распределены по поверхности твёрдой частицы. И при реализации физических условий процесса на поверхности твёрдой частицы образуется фиксированное количество ядер новой фазы. Далее наблюдается рост ядер, что в начальный период времени приводит к увеличению поверхности раздела фаз, а в дальнейшем к её уменьшению.
Математически
эта модель описывается уравнением
сжимающейся сферы: ,
,
где: x – степень превращения твёрдого материала,
k – константа скорости в соответствии с уравнением Аррениуса,
 -
время обработки твёрдого материала.
-
время обработки твёрдого материала.
Модель сжимающейся сферы наиболее хорошо описывает процессы разложения твёрдого материала и некоторые процессы, связанные с присоединением газообразного реагента.
Третья модель.
Модель экспоненциального роста числа ядер новой фазы. Универсальна, описывает любой процесс. Предполагает, что активные центры на поверхности твёрдой частицы энергетически неоднородны. При реализации физических условий процесса ядра новой фазы образуются на активных центрах, обладающих наибольшей избыточной энергией. Появление поверхности раздела фаз приводит к активации центров, обладающих меньшей избыточной энергией в первоначальный момент времени.
Зависимость скорости процесса от времени обработки твёрдого материала.
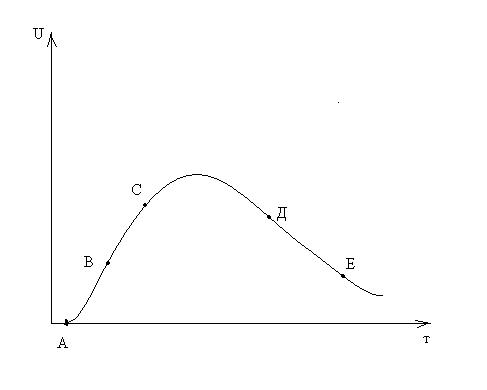
Участок О–А: индукционный период. Он предназначен для накопления энергии в твёрдом веществе. Считается, что в течение индукционного периода протекают первичные превращения, приводящие к возникновению первых ядер новой фазы. Очевидно, что продолжительность индукционного периода зависит от температуры.
Участок А–С: период ускорения. На этом участке протекают два параллельных процесса: образование ядер новой фазы и рост уже образовавшихся. Разбит на две части, чтобы показать, что на начальном этапе (участок А–В ) рост связан именно с увеличением количества ядер новой фазы, а на участке В–С – с ростом ядер.
Участок С–Д : период максимальной скорости. В точке максимума прекращается образование ядер новой фазы.
Участок Д–Е: период спада. В точке Д растущие ядра начинают соприкасаться между собой: из плоских превращаются в шарообразные.
С точки Е процесс переходит в диффузионную область. С этой точки вся поверхность частицы покрыта ядрами новой фазы.
Эта
модель описывается уравнением Ерофеева:
 ,
где
,
где
n – постоянная Ерофеева. Её физический смысл связан с количеством ядер новой фазы, которое активирует одно образовавшееся ядро. Эта величина определяется экспериментально.
