
- •Лекция №1 Введение
- •Лекция №2
- •Равновесие химико-технологических процессов.
- •Количественная оценка смещения равновесия.
- •Лекция №3 Кинетика химических реакций
- •Скорость необратимых реакций
- •Обратимые реакции
- •Лекция №4 Определение оптимальной и равновесной температур для обратимых реакций.
- •Определение оптимальной температуры.
- •2. Определение равновесной температуры.
- •Управление скоростью реакции, протекающей по законам формальной кинетики.
- •Лекция №5
- •Управление состоянием равновесия и скоростью сложных процессов.
- •Влияние температуры, давления и концентрации на скорость параллельных реакций.
- •Лекция №6 Моделирование химического реактора.
- •Лекция №7 Реакторы
- •Модель реактора идеального вытеснения
- •Модель реактора полного смешения
- •Лекция №8
- •Рассматриваем экзотермическую реакцию.
- •Лекция №9 Адиабатический температурный режим.
- •Тепловой эффект химической реакции.
- •Лекция №10 Сравнение адиабатических реакторов при проведении эндотермической реакции.
- •С равнение реакторов при проведении экзотермической реакции.
- •Лекция №11 Оптимизация работы единичного реактора по экономическим критериям
- •Лекция № 11 Гетерогенные процессы.
- •Лекция №12 Внешняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Внутренняя диффузная область протекания гетерогенного процесса в системе газ/твердое вещество.
- •Кинетическая область протекания гетерогенного процесса в системе газ/твердое вещество.
Лекция №9 Адиабатический температурный режим.
Рассмотрим Реактор полного смешения.
Для РПС в качестве элементарного объема мы рассматриваем весь объем реактора, поэтому тепловой баланс мы можем составить для всего реактора в целом.
Тепловой баланс в стационарных условиях будет выглядеть так:
Qвх+Qхим. р.=Qвых
Теплота расходуется на нагрев или охлаждение исходной смеси.
Qвх рассчитывается как произведение начального мольного потока на теплоёмкость реакционной смеси на входе в реактор на входную температуру.
Qвх=NNS·Cpвх·Tвх
NNS [моль/с], Cpвх [Дж/моль·К], Qвх[Дж/с]=[Вт].
Принципиально, эту величину можно определить двумя путями:
путь - Разделить суммарный мольный поток, потом сложить и в результате мы получим число.
NNA·Cpвх·Tвх NNS вычисляется на основе материального баланса
NNB·Cpвх·Tвх
·
·
·
____________
путь менее экстенсивный.

Срвх – средняя теплоёмкость реакционной смеси на входе в реактор;
ZNI- начальная мольная доля i-го компонента; Срвх·ZNI – исходные вещества, реагенты, инерты, которые поступают в реактор.

NKS – мольный поток;
Нам
необходимо рассчитать Твых,
Срвых
зависит
от температуры, но мы вносим допущение

Это вносит ошибку в наш расчет, но она не заметна, так как молярная теплоёмкость веществ, по крайней мере дл веществ, находящихся в газообразной фазе, друг от друга отличаются незначительно. Отсюда, изменение состава не приведет к существенному изменению средней теплоёмкости.
Относительно температурной зависимости мы вносим ошибку и единственным смягчающим обстоятельством в уравнении для скорости процесса будет использование К, и поэтому мы в этом уравнении подставляем величины средней теплоёмкости реакционной смеси на входе в реактор.

Мы
не знаем мольный поток на выходе из
реактора, но мы знаем, что он учитывает
коэффициент изменения числа молей
реакционной смеси, который в свою очередь
учитывается при расчете концентрации
компонентов, входящих в уравнение
скорости процесса, поэтому для
первоначального расчета мы можем принять
 ,
т.е.
,
т.е.

Изменение начального мольного потока – это проценты, теплоёмкости – доли процентов, а температуры – это разы! Вклад выходной температуры будет больше, чем двух других.
Тепловой эффект химической реакции.

qх.р. – удельный тепловой эффект химической реакции;

а – коэффициент при ключевом компоненте;

 ;
;

 ,
, ,
,
Закон
Гесса



Состояние равновесия мы не рассматриваем, и Uх.р. не равно 0.
Можно сократить Uх.р и получим:

Отсюда,

 -
адиабатический коэффициент.
-
адиабатический коэффициент.
Физический смысл этого коэффициента: изменение температуры реакционной смеси при полном превращении ключевого компонента.
Теперь мы получаем:
Математическая модель адиабатического РИВ

Математическая модель адиабатического РПС

Для
РИВ в качестве элементарного объёма
выбираем участок реагирующей среды с
диаметром, равным диаметру реактора и
бесконечно малой длиной l.
Вывод уравнения для РИВ аналогичен
выводу уравнения для РПС, за исключением
выражения для объема реактора: .
.
Тогда
 примет
вид:
примет
вид:

Проектирование адиабатического РИВ.
Для экзотермической реакции

VNS, P, ZNI и Tвх = const.
В адиабатическом температурном режиме температура перестаёт быть управляющим параметром. Управляющий параметр становится температура смеси на входе в реактор.
Рассмотрим, что происходит на границах наших участков.
В
том случае если V=0 X=0,
T=Tвх
и
имеет некоторое значение отличное от
нуля, производительность равна 0.
Поскольку у нас входная температура
имеет какое-то значение, то соответствовать
этой температуре, давлению и составу
будет некоторое значение равновесной
степени превращения.
X=0,
T=Tвх
и
имеет некоторое значение отличное от
нуля, производительность равна 0.
Поскольку у нас входная температура
имеет какое-то значение, то соответствовать
этой температуре, давлению и составу
будет некоторое значение равновесной
степени превращения.
Если будет большой объем реактора (реакция экзотермическая), температура будет увеличиваться, и поэтому, в соответствии с принципом Ле-Шателье, по мере протекания реакции, равновесие смещается в сторону исходных веществ. А поскольку при бесконечном увеличении объема реактора мы будем приближаться к равновесной степени превращения, то скорость будет асимптотически приближаться к нулю, а производительность - к какому- то предельному значению.
Скорость
химической реакции

Поскольку
при протекании реакции температура
будет увеличиваться, один из сомножителей
 будет увеличиваться, а ДС уменьшаться,
при чем движущая сила уменьшается по
двум причинам: увеличение температуры
приводит к уменьшению константы
равновесия, а изменение концентраций
реагентов, а именно уменьшение концентрации
исходных и увеличение концентрации
продуктов, приводит к уменьшению
концентрации составляющей ДС.
будет увеличиваться, а ДС уменьшаться,
при чем движущая сила уменьшается по
двум причинам: увеличение температуры
приводит к уменьшению константы
равновесия, а изменение концентраций
реагентов, а именно уменьшение концентрации
исходных и увеличение концентрации
продуктов, приводит к уменьшению
концентрации составляющей ДС.
Отсюда мы получаем, что скорость будет проходить через экстремум и, когда рост константы скорости превышает снижение ДС, мы находимся в состоянии дали от равновесия, а если ДС мала, то величина константы скорости уде не имеет значения.
Если скорость проходит через экстремум, то зависимость X от Vp будет иметь форму вогнуто-выпуклой кривой. Точка перегиба будет соответствовать максимуму скорости.

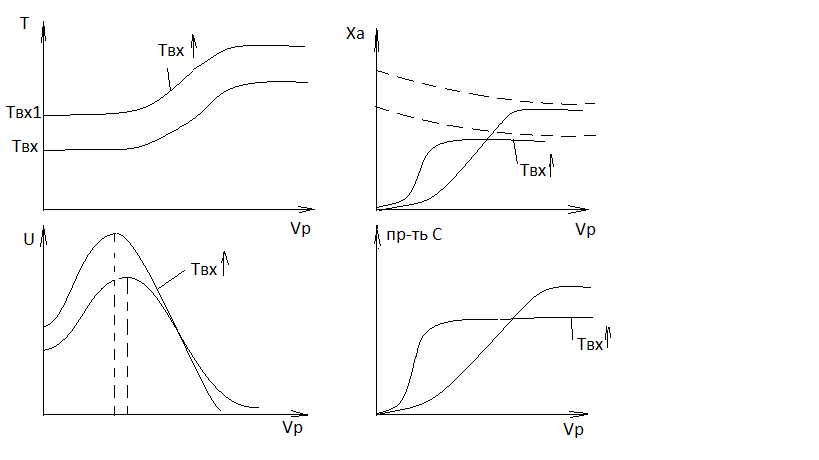
Равновесие будет смещаться в сторону исходных веществ. Скорость существенно возрастет и так же резко уменьшится. Отсюда следует, что при проведении обратимой экзотермической реакции увеличение входной температуры выгодно только в том случае если реакцию проводят вдали от равновесия. Объем реактора, при котором наблюдается пересечение Xa и U не совпадают в связи с тем, что для РИВ, в соответствии с дифференциальной формой уравнения материального баланса производная от степени превращения по объему реактора пропорциональна скорости.

С геометрической точки зрения такая производная есть касательная. В точке пересечения тангенсы угла наклона будут равны.
Для адиабатического РПС характер зависимостей при проведении процесса в адиабатическом режиме аналогичен РИВ, за исключением случая, когда в РПС наблюдается зона множественности стационарных состояний. Применительно к сравнению реакторов, работающих в адиабатическом режиме можно использовать следующую методику. Надо сравнить среднюю скорость.
Экзотермическая реакция

U РИВ UРПС
k
РИВ
 kРПС
kРПС
Д СРИВ ДСРПС
Отсюда вывод, что при проведении обратимой экзотермической реакции РПС будет предпочтительнее в том случае, если процесс проводится вдали от равновесия, РИВ будет предпочтителен если процесс проводится вблизи равновесия. Т. е. если надо обеспечить высокую температуру процесса, то использовать нужно РПС, а если надо обеспечить высокую степень превращения применяют РИВ.
