
- •1)Макросистемы: примеры, особенности, состояния макросистем и способы исследования макросистем. Средние величины по времени, по ансамблю, эргодическая гипотеза.
- •З акон Дальтона: Закон о суммарном давлении смеси газов. Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений
- •3) Основные уравнения молекулярно-кинетической теории идеального газа. Вывод уравнения Клаузиуса и основного уравнения молекулярно-кинетической теории идеального газа. Основное уравнение мкт
- •6)Распределение молекул газа по скоростям – распределение Максвелла. Плотность вероятности. Характерные скорости распределения. Вывод формулы для расчета наиболее вероятной скорости.
- •9)Экспериментальные подтверждения распределение молекул газа по скоростям - опыты Штерна и Ламмерта.
- •22)Прямые циклы. Тепловые машины. Коэффициент полезного действия тепловых машин. II закон термодинамики в формулировке Томсона. Вечный двигатель второго рода.
- •23)Цикл Карно. Расчет кпд идеальной тепловой машины, работающей по прямому обратимому циклу Карно. Теоремы Карно. Способы повышения кпд тепловых машин.
- •24)Обратные циклы. Холодильные машины. Холодильный
1)Макросистемы: примеры, особенности, состояния макросистем и способы исследования макросистем. Средние величины по времени, по ансамблю, эргодическая гипотеза.
Системой называют ограниченную область пространства, в которой находятся объекты исследования. Макросистема – система содержащая огромное количество частиц или объектов. 1 см3 газа 2.7*1019 частиц (Газ – макросистема) Равновесное состояние – состояние когда макро параметры не меняются с течением времени. Неравновесные меняются. Виды макросистем: газ, идеальный газ, плазма, жидкость, твердое тело, жидкие кристаллические тела. Состояния макросистемы:1)равновесное,2)неравновесное. Способы исследования Равновесное 1-молекулярно кинетический, 2-термодинамический. Неравновесное 1-физическая кинетика(явление переноса - диффузия, вязкость, теплопроводность, 2-синергетика(для систем которых длительное время находится в равновесном состоянии не переходя в неравновесное.
2)Уравнение состояния идеального газа – уравнение Менделеева-Клапейрона. Смесь идеальных газов, закон Дальтона. Изопроцессы. Идеальный газ – пример макросистемы, в которой размеры частиц намного меньше, чем расстояния до других частиц, отсутствует взаимодействие м/д частицами и столкновения частиц друг с другом и стенками сосудов абсолютно упруги.
Э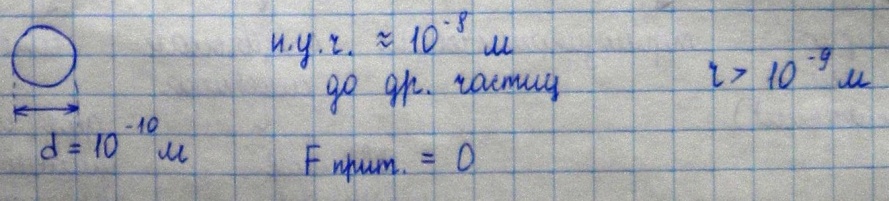
![]()
![]() та
форма записи носит имя уравнения (закона)
Менделеева — Клапейрона. В случае
постоянной массы газа уравнение можно
записать в виде:
та
форма записи носит имя уравнения (закона)
Менделеева — Клапейрона. В случае
постоянной массы газа уравнение можно
записать в виде:
![]()
![]() —
давление,
—
давление,
![]() —
молярный объём,
—
молярный объём,
![]() —
абсолютная
температура,К
—
абсолютная
температура,К
![]() —
универсальная
газовая постоянная.
—
универсальная
газовая постоянная.
З акон Дальтона: Закон о суммарном давлении смеси газов. Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений
Закон о растворимости компонентов газовой смеси
П![]() ри
постоянной температуре
растворимость
в данной жидкости каждой из компонентов
газовой смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.
ри
постоянной температуре
растворимость
в данной жидкости каждой из компонентов
газовой смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.
И
 зопроцессы.
Изопроцессы — термодинамические
процессы, во время которых
масса и ещё одна из физических величин —
параметров состояния: давление,
объём
или температура —
остаётся неизменной. Так, неизменному
давлению соответствует изобарный
процесс, объёму — изохорный,
температуре — изотермический,
энтропии —
адиабатический.. Линии, изображающие
данные процессы на какой-либо
термодинамической диаграмме, называются
изобара,
изохора
, изотерма
и адиабата
соответственно. Изопроцессы являются
частными случаями политропного
процесса.
зопроцессы.
Изопроцессы — термодинамические
процессы, во время которых
масса и ещё одна из физических величин —
параметров состояния: давление,
объём
или температура —
остаётся неизменной. Так, неизменному
давлению соответствует изобарный
процесс, объёму — изохорный,
температуре — изотермический,
энтропии —
адиабатический.. Линии, изображающие
данные процессы на какой-либо
термодинамической диаграмме, называются
изобара,
изохора
, изотерма
и адиабата
соответственно. Изопроцессы являются
частными случаями политропного
процесса.
3) Основные уравнения молекулярно-кинетической теории идеального газа. Вывод уравнения Клаузиуса и основного уравнения молекулярно-кинетической теории идеального газа. Основное уравнение мкт
где
k является постоянной
Больцмана - отношением
газовой постоянной R к числу
Авогадро, а i - число степеней
свободы молекул. Основное уравнение
МКТ связывает макроскопические параметры
(давление,
объём,
температура)
газовой системы с микроскопическими
(масса молекул, средняя скорость их
движения).ОСНОВЫ
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ.
Молекулярно-кинетическая
теория - теория, объясняющая тепловые
явления в макроскопических телах и
свойства этих тел на основе их молекулярного
строения. Основные
положения молекулярно-кинетической
теории:1) вещество
состоит из частиц - молекул и атомов,
разделенных промежутками, 2)эти частицы
хаотически движутся, 3)частицы
взаимодействуют друг с другом. МАССА
И РАЗМЕРЫ МОЛЕКУЛ Массы
молекул и атомов очень малы. Например,
масса одной молекулы водорода равна
примерно 3,34*10
-27 кг, кислорода
- 5,32*10 -26 кг.
Масса одного атома углерода m0C=1,995*10
-26 кг
Относительной
молекулярной (или атомной) массой
в ещества
Mr называют
отношение массы молекулы (или атома)
данного вещества к 1/12 массы атома
углерода:(атомная единица массы).
ещества
Mr называют
отношение массы молекулы (или атома)
данного вещества к 1/12 массы атома
углерода:(атомная единица массы).
![]()
Количество вещества - это отношение числа молекул N в данном теле к числу атомов в 0,012 кг углерода NA:
Моль - количество вещества, содержащего столько молекул, сколько содержится атомов в 0,012 кг углерода. Число молекул или атомов в 1 моле вещества называют постоянной Авогадро:
![]()
М![]() олярная
масса - масса
1 моля вещества:
олярная
масса - масса
1 моля вещества:
Молярная и относительная молекулярная массы вещества связаны соотношением: М = Мr*10 -3 кг/моль.
О сновное
уравнение молекулярно-кинетической
теории можно записать в виде
сновное
уравнение молекулярно-кинетической
теории можно записать в виде
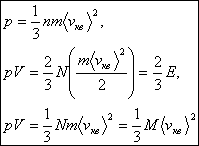 -
основное уравнение молекулярно-кинетической
теории идеальных газов, где
-
основное уравнение молекулярно-кинетической
теории идеальных газов, где
![]() –
средняя квадратичная скорость молекул,
E - суммарная кинетическая
энергия поступательного движения всех
молекул газа, n -
концентрация молекул, m
- масса одной молекулы, M=Nm
- масса газа, N - число молекул в объеме
газа V.
–
средняя квадратичная скорость молекул,
E - суммарная кинетическая
энергия поступательного движения всех
молекул газа, n -
концентрация молекул, m
- масса одной молекулы, M=Nm
- масса газа, N - число молекул в объеме
газа V.
4)Температура
- мера кинетической энергии молекул.
Средняя кинетическая энергия молекул.
Средняя квадратичная скорость молекул.
Скорость
![]() называют средней квадратичной
скоростью
называют средней квадратичной
скоростью
С редняя
кинетическая энергия хаотического
движения молекул газа пропорциональна
абсолютной температуре:
редняя
кинетическая энергия хаотического
движения молекул газа пропорциональна
абсолютной температуре:
![]()
Средняя квадратичная скорость молекул
С![]() равнивая
уравнение состояния идеального газа и
основное уравнение кинетической теории
газов, записанные для одного моля (для
этого число молекул N
возьмём равным числу Авогадро NА),
найдём среднюю кинетическую энергию
одной молекулы:
равнивая
уравнение состояния идеального газа и
основное уравнение кинетической теории
газов, записанные для одного моля (для
этого число молекул N
возьмём равным числу Авогадро NА),
найдём среднюю кинетическую энергию
одной молекулы:
![]()
О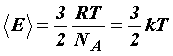 ткуда
ткуда
. (31)
Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
Величина R/NА = k в уравнении (31) получила название постоянной Больцмана и представляет собой газовую постоянную, отнесенную к одной молекуле: k = 1,38·10-23 Дж/К-23.
Так как
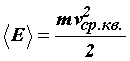 =
=![]() kТ,
то средняя квадратичная скорость равна
kТ,
то средняя квадратичная скорость равна
 . (32)
Подставляя значение средней кинетической
энергии поступательного движения
молекул (31) в основное уравнение
молекулярно–кинетической теории газов,
получим
другую форму уравнения состояния
идеального газа:
. (32)
Подставляя значение средней кинетической
энергии поступательного движения
молекул (31) в основное уравнение
молекулярно–кинетической теории газов,
получим
другую форму уравнения состояния
идеального газа:
P = n0kT. (33)
Давление газа пропорционально произведению числа молекул в единице объема на его термодинамическую температуру.
Молекулярно-кинетическая теория позволяет определить абсолютную температуру идеального газа через среднюю энергию[4] совокупности частиц системы. Из основного уравнения молекулярно-кинетической теории:[5]
![]()
п![]() олучается,
что абсолютная температура пропорциональна
средней энергии:
олучается,
что абсолютная температура пропорциональна
средней энергии:
где i — число
степеней свободы молекул газа; k —
постоянная
Больцмана;
T -абсолютная температура;
![]() —
средняя
энергия,
—
средняя
энергия,
![]() —
энергия каждого j-того атома в случае
одноатомного идеального газа. Ek
может быть разной для разных атомов,
поэтому нельзя говорить о температуре
одного атома
—
энергия каждого j-того атома в случае
одноатомного идеального газа. Ek
может быть разной для разных атомов,
поэтому нельзя говорить о температуре
одного атома
5)Степени свободы. Закон Больцмана о равнораспределении молекул по степеням свободы движения молекул. Числом степени свободы – называют числом независимых координат, с помощью которых можно определить положение тела в пространстве. Жесткая связь молекул предполагает 1)поступательное движение, 2) вращательное движение. Упругая связь предполагает 1) поступательное движение, 2) вращательное, 3) колебательное. i= iпост+iвращ+iколеб
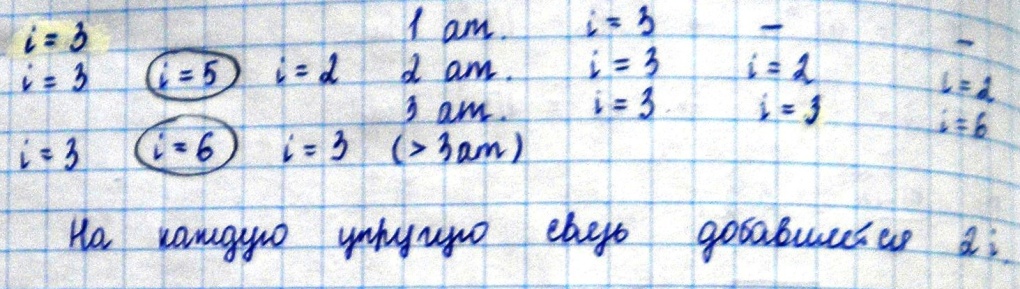
Теорема Больцмана На каждую степень свободы поступательного и вращательного движения среднем приходится одинаковая энергия, равная 1/2KT (дописать в ручную)
