
- •Реферат
- •Введение
- •Обзор и анализ научно технической и патентной информации.
- •Нейтрофины.
- •Общая характеристика.
- •1.2 Нейротрофины в цнс
- •2. Рецепторы нейтрофинов.
- •2.1Высокоаффинный рецептор к нейротрофинам pl40 prototrk
- •2.2 Низкоаффинный рецептор к нейротрофинам p75lntr.
- •Фактор роста нервов.
- •История открытия
- •3.2 Молекулярная характеристика.
- •Третичная структура.
- •3.4 Механизм взаимодействия ngf с рецепторами.
- •3.5 Захват и ретроградный транспорт ngf.
- •3.6 Функции ngf в организме.
- •3.6.1 Действие ngf на нервные клетки.
- •3.6.2 Значение ngf в метаболизме.
- •3.6.3 Участие ngf в патологических состояниях.
- •4. Современные достижения в получении рекомбинантного ngf для фармацевтической индустрии.
- •5 Экспрессия рекомбинантных генов.
- •5.1 Вводная часть.
- •5.2 Конструирование экспрессионных векторов и их функционирование.
- •5.3 Факторы, оказывающие влияние на эффективность экспрессии рекомбинантных генов.
- •6 Выводы по разделу
- •Основная часть
- •1. Материалы, методы и оборудование
- •1.1 Оборудование
- •1.2 Программное обеспечение
- •1.3 Лабораторные посуда и расходные материалы.
- •1.4 Штаммы e.Coli
- •1.5 Среды для выращивания бактерий
- •1.6 Препараты днк
- •1.7 Ферменты
- •1.7 Реактивы и наборы реактивов
- •Приготовление рвs буфера (х10):
- •10% Уксусная кислота
- •1.9.1 Рестрикция
- •1.9.2 Электрофоретичское разделение днк в агарозном геле.
- •1.9.3 Выделение днк из агарозного геля.
- •1.9.4. Полимеразная цепная реакция (пцр).
- •1.9.5 Лигирование.
- •1.9.6 Pipes трансформация клеток e. Coli плазмидной днк
- •1.9.7 Культивирование, выделение и очистка плазмидной днк из клеток e. Coli
- •1.9.8 Проведение пцр-скрининга.
- •1.9.9 Секвенированиеплазмидной днк.
- •1.9.10 Быстрая трансформация.
- •1.9.11 Анализ экспрессии целевого гена.
- •1.9.12 Выделение суммарного (общего) белка из клеток e. Сoli.
- •1.9.14 Фракционирование белков из клеток e. Сoli.
- •1.9.15 Денатурирующий белковый электрофорез в sds-пааг.
- •1.9.16 Отмывка телец включения
- •1.9.17 Растворение телец включения
- •1.9.18 Выделение SumoNgf при помощи металло-хелат-аффинной хроматографии
- •1.9.19 Рефолдинг белка
- •1.9.20 Расщепление гибридного белка SumoNgf
- •2. Экспериментальные исследования
- •2.1 Получение векторных конструкций.
- •2.1.1 Сборка гена ngf методом пцр.
- •2.1.2 Получение векторной конструкции pTngf
- •2.1.3 Получение гибридной последовательности SumoNgf.
- •2.1.4 Получение векторной конструкции pTSumoNgf.
- •2.2 Биосинтез целевого и гибридного белка. Подбор условий культивирования.
- •2.2.1 Биосинтез белка ngf.
- •2.2.1 Биосинтез гибридного белка SumoNgf.
- •2.3 Выделение и очистка рекомбинантного фактора роста нервов человека.
- •2.3.1 Отмывка и растворение телец включения
- •2.3.2 Металло-хелатная аффинная хроматография
- •2.3.3 Масс-спектрометрия гибридного белка ngf
- •2.3.4 Рефолдинг гибридного белка SumoNgf
- •2.3.5 Ферментативное расщепление гибридного белка SumoNgf
- •2.3.5 Очистка ngf на катионобменной хроматографии.
- •2.3.5 Разработка обобщённой схемы производства рекомбинантного ngf
- •Организационно – экономический раздел
- •Технико-экономическое обоснование нир
- •2. Расчёт затрат на научно-исследовательскую работу
- •2.1. Расчет материальных затрат (Cм)
- •2.2. Энергетические затраты.
- •4.2.3. Расчет затрат на заработную плату.
- •2.4. Расчет затрат на стеклянную посуду, стеклянные приборы и пластик.
- •4.2.5. Амортизационные отчисления (Сам.).
- •2.6. Накладные расходы.
- •3 Выводы по разделу
- •Безопасность жизнедеятельности
- •1 Краткая характеристика выполняемой работы.
- •2 Опасные и вредные производственные факторы на основных стадиях выполнения дипломной работы.
- •3 Перечень наиболее опасных мест на стадиях выполнения дипломной работы.
- •Основные физико-химические, токсические и пожаровзрывоопасные свойства используемых в работе веществ.
- •5 Обеспечение безопасности труда в лаборатории.
- •6 Производственная санитария.
- •6.1 Установление категории лабораторного помещения.
- •6.2 Разработка мероприятий по работе с вредными веществами.
- •6.3 Метеорологические условия.
- •6.4 Вентиляция.
- •6.5 Освещение.
- •6.7 Отопление.
- •7 Техника безопасности.
- •7.1 Электробезопасность.
- •7.2 Пожарная профилактика.
- •8. Выводы по разделу.
2.2 Биосинтез целевого и гибридного белка. Подбор условий культивирования.
2.2.1 Биосинтез белка ngf.
Для наработки целевого белка NGF производили трансформацию клеток штамма E.coli BL21(DE3) полученной векторной конструкцией pTNGF. Культивирование проводили при температуре 37oС в течении 24 часов на автоиндукционной среде TB – 5052 и средах с различной концетрацией ИПТГ. Изопропил-β-D-1-тиогалактопиранозид (ИПТГ, англ. IPTG) — реагент, используемый в молекулярной биологии. ИПТГ используют в качестве аналога аллолактозы, метаболита лактозы, который запускает транскрипцию lac-оперона [].
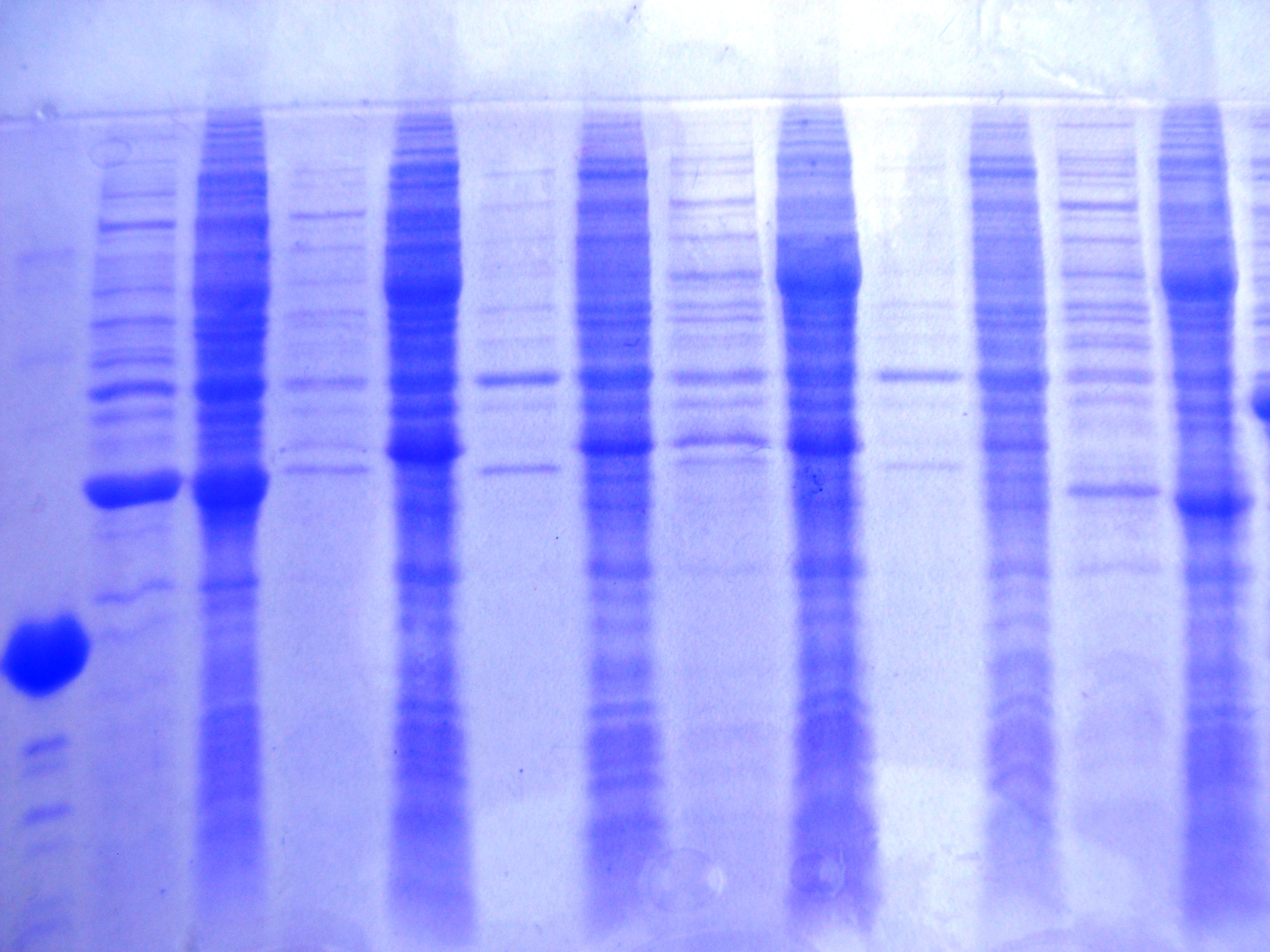
По окончанию культивирования штамма – продуцента, анализ экспрессии осуществляли с помощью белкового электрофореза (Рисунок _ ).
Результаты эксперимента показывают, что больше всего белка накапливалось в культуральной жидкости при выращивании на автоиндукционной среде. Данный белок имел молекулярную массу около 32 кДа, что не соответствует подвижности фактора роста нервов. Согласно литературным источником данную молекулярную массу имеет фермент β-лактамаза, который отвечает за резистентность бактерий к бета –лактамным антибиотикам. Накопление данного фермента в больших количествах говорит о том, что прямая экспрессия NGF не идет []
 1
2 3 4 5 6 7 8 9 10 11
12 13
1
2 3 4 5 6 7 8 9 10 11
12 13
32 кДа
25 кДа
Рисунок _ - Анализ экспрессии NGF на автоиндукционой среде и средах с ИПТГ. Температура культивирования 37°С. Клетки E.coli BL21(DE3).
Белковый маркер молекулярной массой 25 кДа.
Автоиндукционная среда. Культуральная жидкость.
Автоиндукционная среда. Клетки.
Концентрация индуктора IPTG 0 мМ. Культуральная жидкость.
Концентрация индуктора IPTG 0 мМ. Клетки.
Концентрация индуктора IPTG 0.01 мМ. Культуральная жидкость.
Концентрация индуктора IPTG 0.01 мМ. Клетки.
Концентрация индуктора IPTG 0.05 мМ. Культуральная жидкость.
Концентрация индуктора IPTG 0.05 мМ. Клетки
Концентрация индуктора IPTG 0.25 мМ. Культуральная жидкость.
Концентрация индуктора IPTG 0.25 мМ. Клетки
Концентрация индуктора IPTG 1 мМ. Культуральная жидкость.
Концентрация индуктора IPTG 1 мМ. Клетки
Данный опыт говорит о том, что кишечная палочка не может синтезировать фактор роста нервов при прямой экспрессии. Возможно данный факт может быть объяснен небольшой молекулярной массой целевого белка, а также наличием трёх дисульфидных связей, которые стабилизируют молекулу. Все это усложняет биосинтез белка, так как кишечная палочка не способна правильно формировать дисульфидные связи из–за более восстановленного прокариотического цитозоля по сравнению с эукариотическим. В результате белок имеет неупорядоченную структуру и подвергается воздействию протеиназ, которые расщепляют его, а синтезируются другие бактериальные белки.
2.2.1 Биосинтез гибридного белка SumoNgf.
Для решения проблемы, возникшей при прямой экспрессии NGF, был предложен метод гибридной экспрессии. Технология гибридной экспрессии открывает широкие возможности для очистки рекомбинантных белков. В качестве партнеров для слияния можно выбрать разные последовательности, например, гексагистидиновый фрагмент, стрептавидин, MBP. После чего изолировать рекомбинантный белок становится достаточно просто, используя аффинные смолы, где в качестве функциональных групп присутствуют никель-нитрилтриуксусная кислота, биотин или амилоза соответственно. Таким образом, очистка рекомбинантных белков заметно упрощается, стоит только подобрать подходящий аффинный фрагмент (таг) и смолу. Еще более удобным процесс получения рекомбинантных белков делает доступность коммерческих векторов, уже содержащих последовательности белков-партнеров [].
Присоединение тагов к целевому белку также полезно при идентификации рекомбинантного белка. В данном случае целесообразно использовать антитела к таким добавкам [].
Для гибридной экспрессии был выбран белок – партнёр SUMO (small-ubiquitin-related-modifier). Это небольшой, примерно 100 аминокислотных остатков белок, модулирующий структуру и функцию эукариотических белков путем ковалентной модификации. Известно три высокогомологичных гена SUMO у млекопитающих и только один у Saccharomyces cerevisiae.
Пространственная структура SUMO сходна с пространственной структурой убиквитина, и представляет собой плотную глобулярную структуру, где β-слои обернуты вокруг одной α-спирали.
При синтезе целевого белка в слитом с SUMO виде, наблюдается заметное увеличение экспрессии гена рекомбинантного белка, кроме того, увеличивается его растворимость []. Влияние SUMO на растворимость, видимо, связано со структурой данного белка. Его внешняя гидрофильная оболочка и внутренний гидрофобный кор могут оказывать тот же эффект, что и детергенты при солюбилизации.
Другим положительным качеством слитной продукции с SUMO является простота расщепления гибридных продуктов SUMO-гидролазами. Для расщепления гибридного белка они не требуют наличия специфической последовательности и не модифицируют N-конец целевого белка. Поскольку SUMO-гидролазы узнают третичную структуру SUMO, а не специфическую последовательность, то могут быть использованы самые разные партнеры для гибридной экспрессии. Единственным ограничением является продукция целевых белков с N-концевым пролином, поскольку SUMO-гидролазы не могут расщепить такие гибриды. SUMO-гидролазы очень устойчивы, доступны коммерчески, кроме того, они эффективны в широком диапазоне температур (4-37oC), pH (pH 6-10,5) и в присутствии различных хроматографических реагентов [].
Для экспрессии гена NGF в составе ранее полученной плазмиды pTSNGF был выбран штамм E. coli BL21 (DE3). После трансформации бактериальных клеток осуществляли подбор условий культивирования. Для выращивания рекомбинантного штамма использовались среды автоиндукционные среды TB – 5052, 2 ZYM – 5052 а также неавтоиндукционная среда MGD +. Заражали 1 колонией на 1 мл. среды. Культивирование проводили в течении 24 часов при температурах 37 oC и 25 oC.
По окончанию инкубации из каждой колбы отбирали образцы для белкового электрофореза (Рисунок _ ) Отобранные образцы разделяли на культуральную жидкость и биомассу и наносили на гель.
1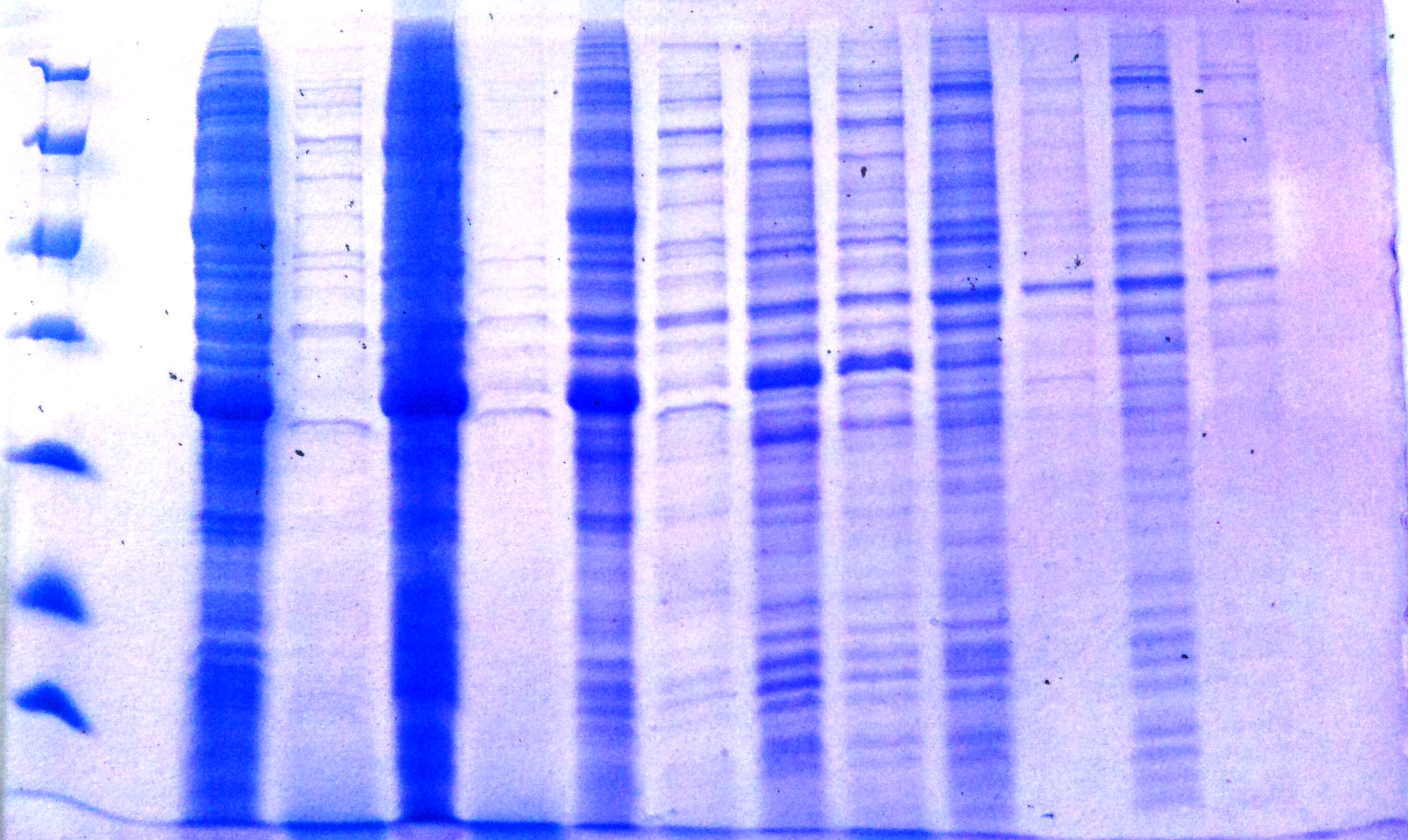 00
кДа
00
кДа
75 кДа
50 кДа
37 кДа
25 кДа
20 кДа
10 кДа
1 2 3 4 5 6 7 8 9 10 11 12 13
Рисунок _- Подбор условий культивирования штамма – продуцента гибридного белка SumoNGF.
Белковый маркер.
Биомасса клеток. Автоиндукционная среда TB – 5052, 37 oC
Культуральная жидкость. Автоиндукционная среда TB – 5052, 37 oC
Биомасса клеток. Автоиндукционная среда TB – 5052, 25 oC
Культуральная жидкость. Автоиндукционная среда TB – 5052, 25 oC
Биомасса клеток. Автоиндукционная среда 2ZYM – 5052, 37 oC
Культуральная жидкость. Автоиндукционная среда 2ZYM – 5052, 37 oC
Биомасса клеток. Автоиндукционная среда 2ZYM – 5052, 25 oC
Культуральная жидкость. Автоиндукционная среда 2ZYM – 5052, 25 oC
Биомасса клеток. Автоиндукционная среда MGD +, 25 oC
Культуральная жидкость. Автоиндукционная среда MGD +, 25 oC
Б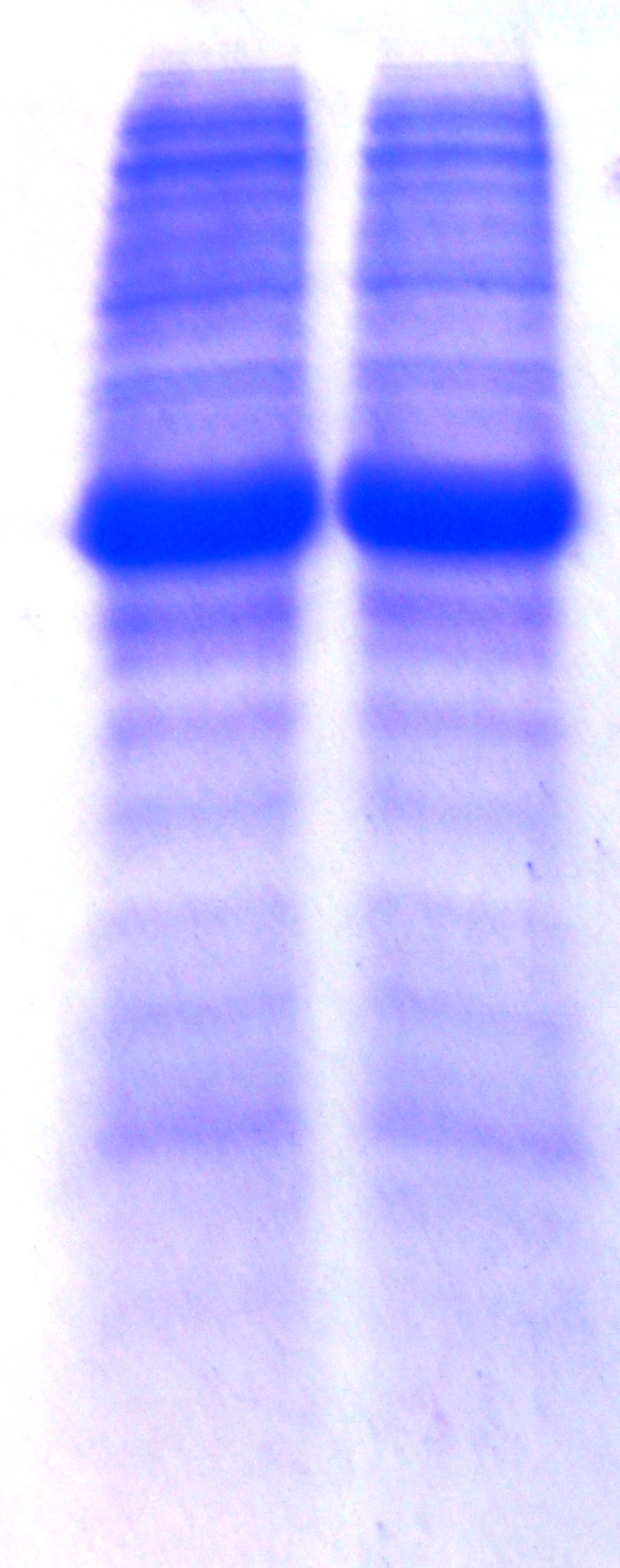 ыло
обнаружено, что максимальный уровень
синтеза гибридного белка наблюдается
в клетках, при культивировании на
автоиндукционных средах TB
– 5052 и 2ZYM
– 5052 при 37
oC.
На среде MGD
+ накопление нужного белка не происходило.
При масштабировании культивирования
микроорганизма – продуцента
автоиндукциоонные среды заражали 3
колониями на 1 мл. В результате было
установлено, что наиболее благоприятной
средой для выращивания трансформированных
клеток бактерий является автоиндукционная
среда 2ZYM
– 5052, при выращивании на которой
концентрация белка фактора роста нервов
1г/мл (Рисунок _ ).
ыло
обнаружено, что максимальный уровень
синтеза гибридного белка наблюдается
в клетках, при культивировании на
автоиндукционных средах TB
– 5052 и 2ZYM
– 5052 при 37
oC.
На среде MGD
+ накопление нужного белка не происходило.
При масштабировании культивирования
микроорганизма – продуцента
автоиндукциоонные среды заражали 3
колониями на 1 мл. В результате было
установлено, что наиболее благоприятной
средой для выращивания трансформированных
клеток бактерий является автоиндукционная
среда 2ZYM
– 5052, при выращивании на которой
концентрация белка фактора роста нервов
1г/мл (Рисунок _ ).
Рисунок _ - Экспрессия гибридного белка SumoNGF, при выращивании штамма – продуцента на среде 2ZYM – 5052.
1,2. Экспрессия гибридного белка SumoNGF
1 2
П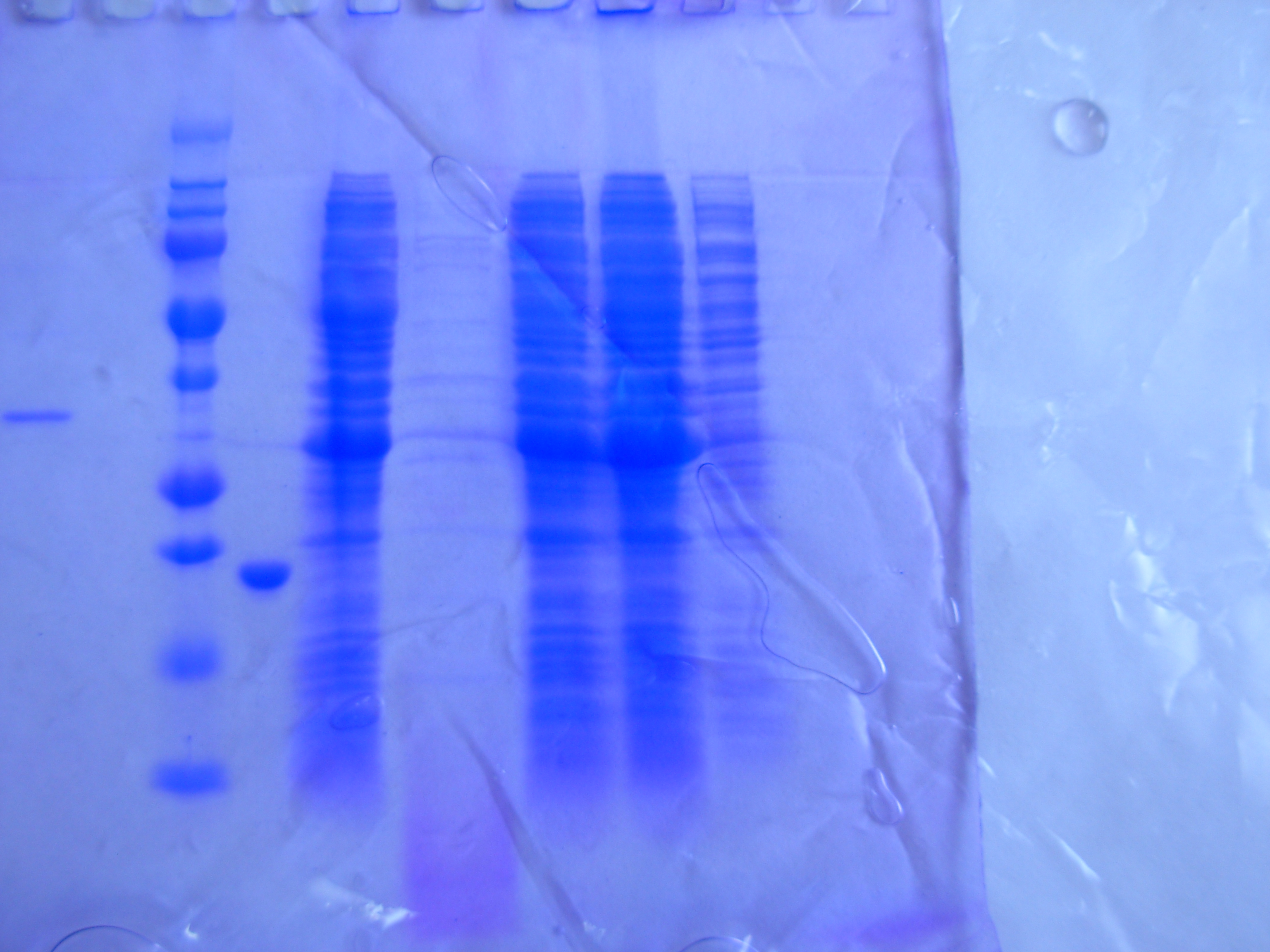
 ри
оптимизации культивирования было
установлено, что при температуре 37°С
SumoNGF
накапливается в клетках в виде телец
включения (Рисунок _).
ри
оптимизации культивирования было
установлено, что при температуре 37°С
SumoNGF
накапливается в клетках в виде телец
включения (Рисунок _).
1 2 3 4
75кДа
50 кДа
37 кДа
25 кДа
20 кДа
15 кДа
10 кДа
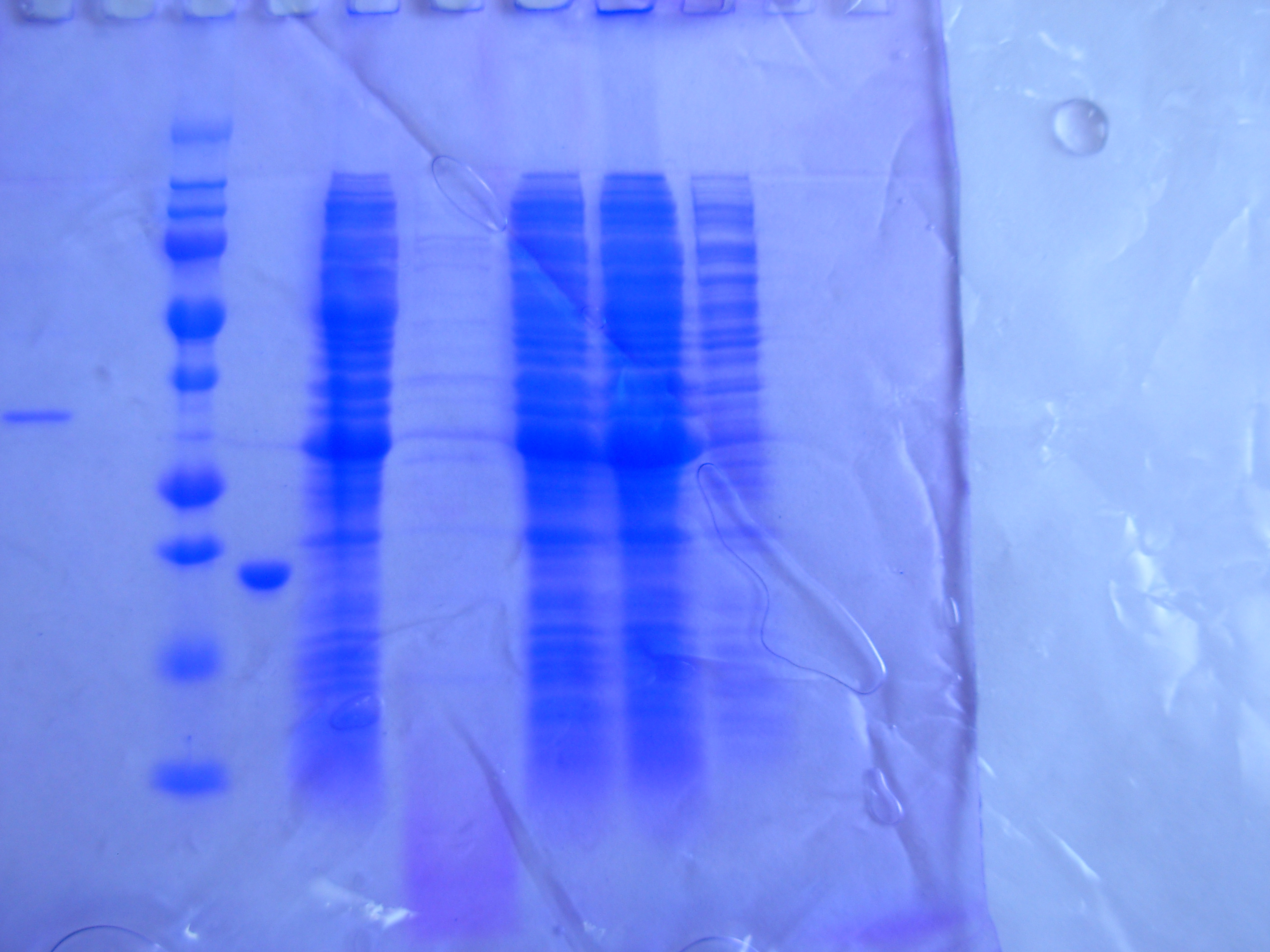
Рисунок _. - Анализ клеток на растворимый и нерастворимый белок.
Белковый маркер
Фракция общего белка клеток
Фракция нерастворимого белка клеток
Фракция растворимого белка клеток
Индуцибельные системы экспрессии, в которых Т7 РНК – полимераза транскрибирует, клонированные под Т7 Lac - промотор последовательности, в настоящее время эффективно используются для получения большого разнообразия белков в Escherichia coli. Особое внимание уделяется автоиндукционным питательным средам.
Идея автоиндукции состоит в том, чтобы полностью блокировать активность гена до момента индукции. Практически это реализуется путем добавления в среду глюкозы и лактозы в определенном соотношении. Глюкоза является репрессором, а лактоза – активатором экспрессии генов, стоящих под контролем Lac-промотора. Присутствие глюкозы позволяет подавить базальную транскрипцию, что дает возможность трансформированным клеткам активно делиться. К тому моменту, как запасы глюкозы в среде истощаются, трансформированная культура клеток уже достигает достаточно высокого значения оптической плотности (2-3 о.е.). Истощение запасов глюкозы вынуждает клетки использовать лактозу в качестве источника углерода. Поскольку лактоза является активатором транскрипции, запускается экспрессия гена SumoNGF. Автоиндукционные среды более практичны и позволяют уменьшить в несколько раз количество колб при оптимизации условий выращивания культур. Стабильность и жизнеспособность культур, выращенных в автоиндукционных средах позволяет работать с ними при замораживании в течении нескольких недель. Автоиндукция удобна, эффективна и экономична для того, чтобы произвести белки в почти любом масштабе, от анализа индивидуальных белков в небольших лабораториях к производству многих различных белков в крупных проектах, и возможно даже для производства белков в коммерческих масштабах [].
