
- •Реферат
- •Введение
- •Обзор и анализ научно технической и патентной информации.
- •Нейтрофины.
- •Общая характеристика.
- •1.2 Нейротрофины в цнс
- •2. Рецепторы нейтрофинов.
- •2.1Высокоаффинный рецептор к нейротрофинам pl40 prototrk
- •2.2 Низкоаффинный рецептор к нейротрофинам p75lntr.
- •Фактор роста нервов.
- •История открытия
- •3.2 Молекулярная характеристика.
- •Третичная структура.
- •3.4 Механизм взаимодействия ngf с рецепторами.
- •3.5 Захват и ретроградный транспорт ngf.
- •3.6 Функции ngf в организме.
- •3.6.1 Действие ngf на нервные клетки.
- •3.6.2 Значение ngf в метаболизме.
- •3.6.3 Участие ngf в патологических состояниях.
- •4. Современные достижения в получении рекомбинантного ngf для фармацевтической индустрии.
- •5 Экспрессия рекомбинантных генов.
- •5.1 Вводная часть.
- •5.2 Конструирование экспрессионных векторов и их функционирование.
- •5.3 Факторы, оказывающие влияние на эффективность экспрессии рекомбинантных генов.
- •6 Выводы по разделу
- •Основная часть
- •1. Материалы, методы и оборудование
- •1.1 Оборудование
- •1.2 Программное обеспечение
- •1.3 Лабораторные посуда и расходные материалы.
- •1.4 Штаммы e.Coli
- •1.5 Среды для выращивания бактерий
- •1.6 Препараты днк
- •1.7 Ферменты
- •1.7 Реактивы и наборы реактивов
- •Приготовление рвs буфера (х10):
- •10% Уксусная кислота
- •1.9.1 Рестрикция
- •1.9.2 Электрофоретичское разделение днк в агарозном геле.
- •1.9.3 Выделение днк из агарозного геля.
- •1.9.4. Полимеразная цепная реакция (пцр).
- •1.9.5 Лигирование.
- •1.9.6 Pipes трансформация клеток e. Coli плазмидной днк
- •1.9.7 Культивирование, выделение и очистка плазмидной днк из клеток e. Coli
- •1.9.8 Проведение пцр-скрининга.
- •1.9.9 Секвенированиеплазмидной днк.
- •1.9.10 Быстрая трансформация.
- •1.9.11 Анализ экспрессии целевого гена.
- •1.9.12 Выделение суммарного (общего) белка из клеток e. Сoli.
- •1.9.14 Фракционирование белков из клеток e. Сoli.
- •1.9.15 Денатурирующий белковый электрофорез в sds-пааг.
- •1.9.16 Отмывка телец включения
- •1.9.17 Растворение телец включения
- •1.9.18 Выделение SumoNgf при помощи металло-хелат-аффинной хроматографии
- •1.9.19 Рефолдинг белка
- •1.9.20 Расщепление гибридного белка SumoNgf
- •2. Экспериментальные исследования
- •2.1 Получение векторных конструкций.
- •2.1.1 Сборка гена ngf методом пцр.
- •2.1.2 Получение векторной конструкции pTngf
- •2.1.3 Получение гибридной последовательности SumoNgf.
- •2.1.4 Получение векторной конструкции pTSumoNgf.
- •2.2 Биосинтез целевого и гибридного белка. Подбор условий культивирования.
- •2.2.1 Биосинтез белка ngf.
- •2.2.1 Биосинтез гибридного белка SumoNgf.
- •2.3 Выделение и очистка рекомбинантного фактора роста нервов человека.
- •2.3.1 Отмывка и растворение телец включения
- •2.3.2 Металло-хелатная аффинная хроматография
- •2.3.3 Масс-спектрометрия гибридного белка ngf
- •2.3.4 Рефолдинг гибридного белка SumoNgf
- •2.3.5 Ферментативное расщепление гибридного белка SumoNgf
- •2.3.5 Очистка ngf на катионобменной хроматографии.
- •2.3.5 Разработка обобщённой схемы производства рекомбинантного ngf
- •Организационно – экономический раздел
- •Технико-экономическое обоснование нир
- •2. Расчёт затрат на научно-исследовательскую работу
- •2.1. Расчет материальных затрат (Cм)
- •2.2. Энергетические затраты.
- •4.2.3. Расчет затрат на заработную плату.
- •2.4. Расчет затрат на стеклянную посуду, стеклянные приборы и пластик.
- •4.2.5. Амортизационные отчисления (Сам.).
- •2.6. Накладные расходы.
- •3 Выводы по разделу
- •Безопасность жизнедеятельности
- •1 Краткая характеристика выполняемой работы.
- •2 Опасные и вредные производственные факторы на основных стадиях выполнения дипломной работы.
- •3 Перечень наиболее опасных мест на стадиях выполнения дипломной работы.
- •Основные физико-химические, токсические и пожаровзрывоопасные свойства используемых в работе веществ.
- •5 Обеспечение безопасности труда в лаборатории.
- •6 Производственная санитария.
- •6.1 Установление категории лабораторного помещения.
- •6.2 Разработка мероприятий по работе с вредными веществами.
- •6.3 Метеорологические условия.
- •6.4 Вентиляция.
- •6.5 Освещение.
- •6.7 Отопление.
- •7 Техника безопасности.
- •7.1 Электробезопасность.
- •7.2 Пожарная профилактика.
- •8. Выводы по разделу.
2.1.3 Получение гибридной последовательности SumoNgf.
Этапы получения гибридной последовательности SumoNGF представлены на рисунке _ . На первом этапе c помощью ПЦР была накоплена ДНК фрагментов NGF и SUMO. В качестве матрицы для накопления гена NGF брали заранее полученную плазмиду pTNGF и использовали прямой праймер NG и обратный праймер Sp6 (ПЦР №1). В качестве матрицы для накопления гена SUMO брали плазмиду pTS и использовали прямой праймер T7 и обратный праймер SU (ПЦР №2). Благодаря специально подобранным праймерам каждый фрагмент имеет выступающий не амплифицирующийся конец, которые комплементарны друг другу. На втором этапе ставили ПЦР №3. В качестве матрицы брали полученные фрагменты SUMO и NGF и используя прямой праймер Т7 на SUMO и обратный праймер на NGF.В результате комплементарного взаимодействия двух последовательностей получили фрагмент SumoNGF, который в дальнейшем использовался для создания экспрессионной конструкции.
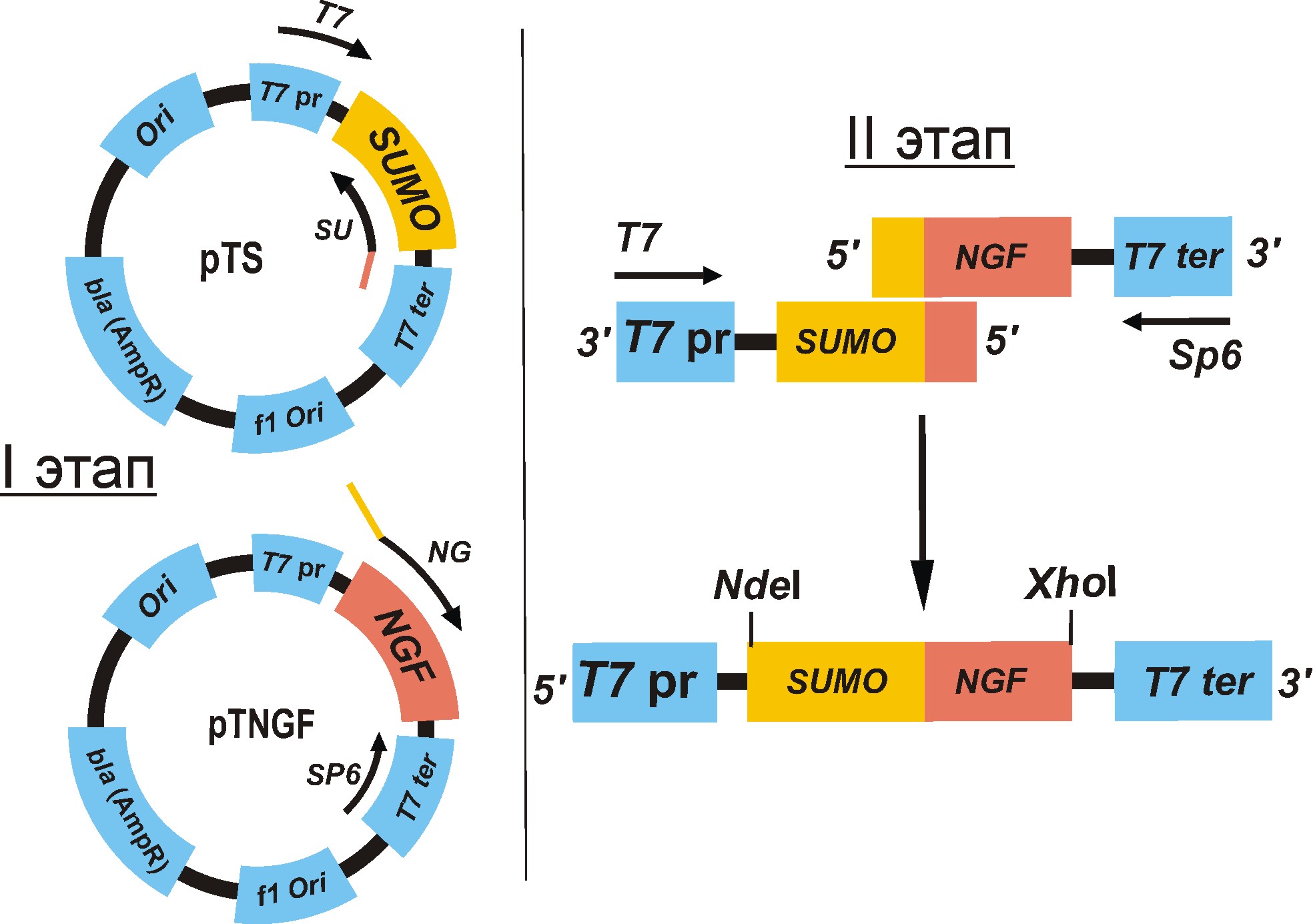
Рисунок _. - Этапы получения гибридной последовательности SumoNGF
2.1.4 Получение векторной конструкции pTSumoNgf.
Экспрессионная плазмида для гибридной экспрессии собиралась аналогично первой конструкции. Полученную вышеуказанным способом последовательность гена гибридного белка с SUMO проклонировали по сайтам рестрикции NdeI и XhoI.в плазмиду pGEMEX1. Лигазную смесью, трансформировали компетентные клетки штамма XL1-Blue. Затем трансформированные клетки высевали на агаризованную среду YT с ампициллином, в качестве селективного агента
Основные этапы для сборки векторной конструкции pTSumoNGF представлены на рисунке_
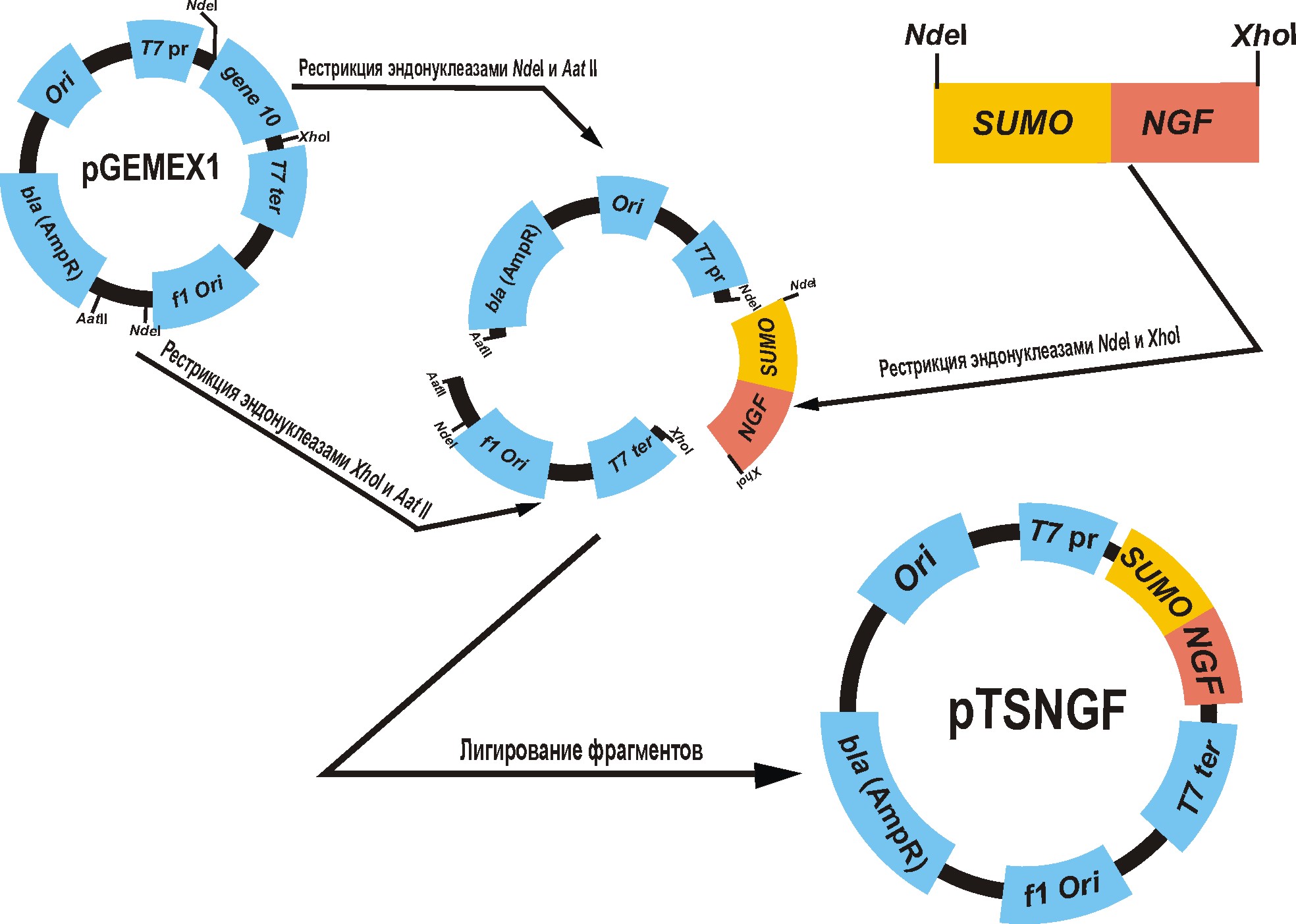
Рисунок _. - Основные этапы сборки векторной конструкции pTSumoNGF.
 1
2 3 4 5 6 7 8 9
10 11
1
2 3 4 5 6 7 8 9
10 11
1 2 3 4 5 6 7 8 9
10 11 12 13 14 15 16 17 18
12 13 14 15 16 17 18 19 20 21 22
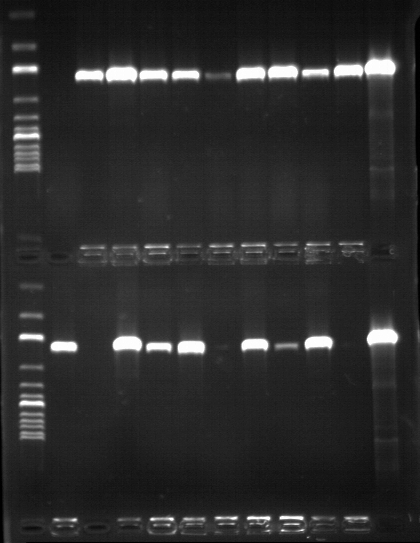
Рисунок _ - ПЦР – скрининг бактериальных клонов.
1, 12 – ДНК маркер, 2-10,13 -21 - плазмидная ДНК бактериальных клонов № 1-18, 11, 22 - положительный контроль, фрагмент NGF.
Бактериальные клоны анализировали на содержание нужного фрагмента быстрым ПЦР-скринингом, используя праймеры SMseq и Sp6 на начало и конец последовательности SumoNGF (Рисунок _ ).
Результаты скрининга показали, что у всех клонов кроме №14 и №18 наработался фрагмент теоретически рассчитанного размера (Рисунок _ ). Это говорит о том что лигирование прошло правильно Для дальнейшего исследования было отобрано 10 клонов (№ 1, 2, 6, 7, 9, 10 , 11, 13, 15, 17 ). Плазмиды отобранных клонов анализировали с помощью рестриктного анализа по сайтам рестрикции
 1
2 3 4 5 6 7 8 9 10 11
12
1
2 3 4 5 6 7 8 9 10 11
12
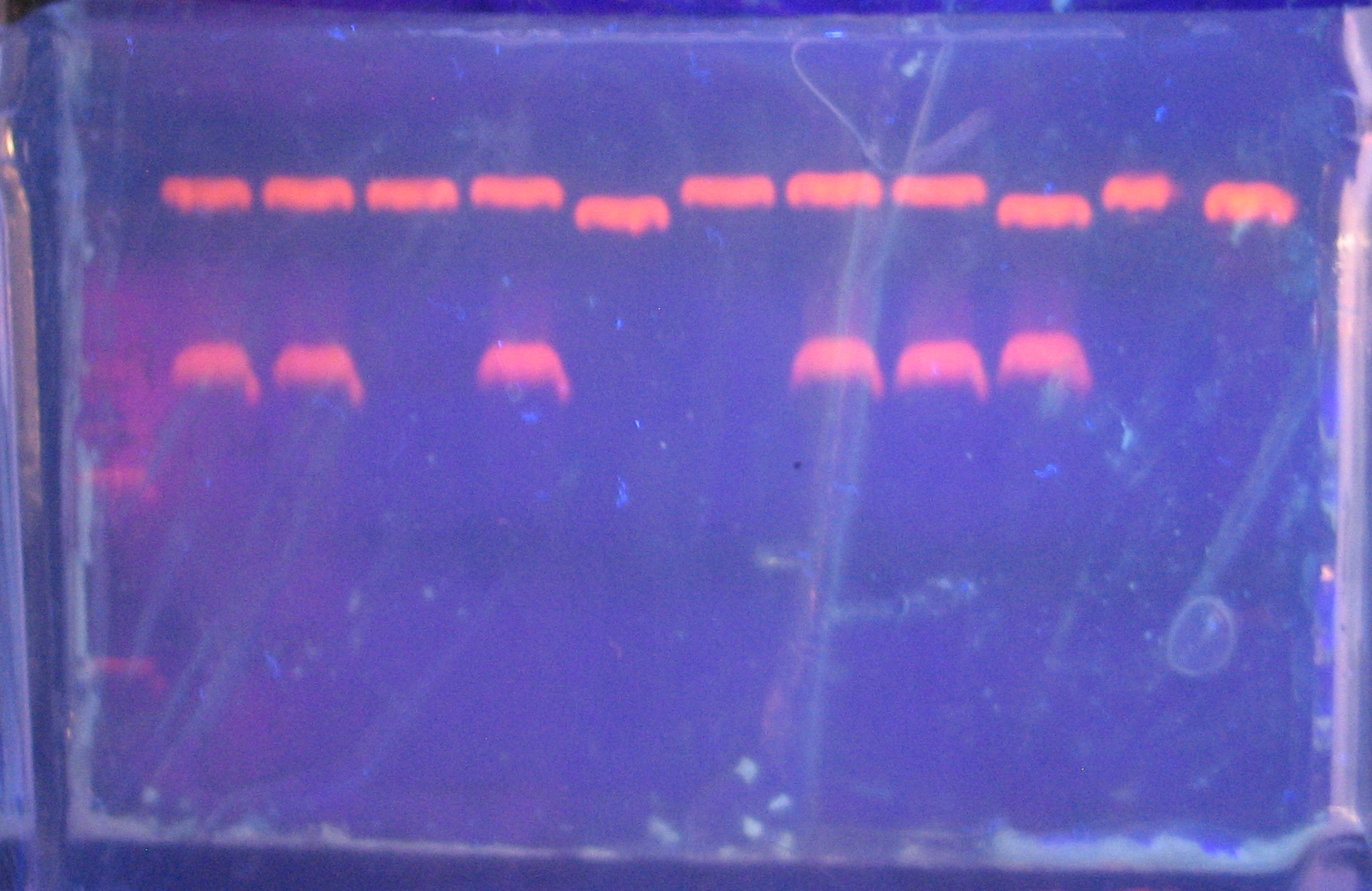
Рисунок _ . – Рестрикционный анализ плазмиды pTSumoNGF
1. –ДНК маркер, 2 -11. - рестрикционный анализ плазмид клонов № 1, 2, 6, 7, 9, 10 , 11, 13, 15, 17 соответственно, 12. – положительный контроль плазмида pGEMEX1.
Перечисленные бактериальные инокулировали в 3 мл YT среды и выращивали в течение ночи при 37оС в стерильных пробирках на 15 мл. С 3 мл. ночной культуры была собрана биомасса и выделена плазмидная ДНК при помощи набора QIAprep Spin Miniprep Kit (QIAGEN). Полученные векторные конструкции № 1, № 2, №6, № 7, № 9 были отданы в Межинститутский Центр коллективного пользования “ГЕНОМ” Центр “Биоинженерия” РАН. Правильность последовательности ДНК гена SumoNGF и сопутствующих областей в плазмиде была подтверждена секвенированием (Приложение _ )
