
- •Общая и неорганическая химия
- •Часть 1 общие вопросы химии
- •Содержание
- •Введение ..………………………………………………………..29
- •7.5 Расчёт концентраций ионов в растворах
- •Основные химические понятия
- •Основные классы неорганических соединений
- •2.1 Введение
- •2.2 Оксиды
- •2.3 Основания
- •2.4 Кислоты
- •2.4.1 Классификация кислот
- •2.4.2 Номенклатура кислот и их солей
- •Продолжение таблицы 2.1
- •2.5 Соли
- •2.5.1 Номенклатура средних, кислых и основных солей
- •2.5.2 Солеобразные оксиды
- •2.5.3 Диссоциация солей в водных растворах
- •Стехиометрические законы химии
- •Типы химических реакций
- •4.1 Введение
- •4.2 Реакции ионного обмена
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •4.3.2 Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
- •2 Cu(oh)2 Cu2o hcho co2
- •Понятие о химическом равновесии
- •Количественной характеристикой системы в состоянии химического равновесия является константа равновесия k.
- •5.2 Смещение химического равновесия. Принцип Ле-Шателье
- •5.3 Основные типы задач на химическое равновесие
- •Общие свойства растворов
- •6.1 Характеристика растворов. Процесс растворения
- •6.2 Способы выражения концентрации растворов
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •6.3 Растворимость
- •Растворы электролитов
- •7.1 Основные положения теории электролитической диссоциации
- •7.2 Степень диссоциации
- •7.3 Константа диссоциации
- •7.4 Расчёт концентраций ионов в растворах сильных электролитов
- •7.5 Расчёт концентраций ионов в растворах слабых электролитов
- •7.6 Закон разбавления Оствальда
- •7.7 Диссоциация воды. Водородный показатель
- •7.8 Понятие о буферных растворах
- •7.9 Произведение растворимости
- •0,1 Моль/л 0,1
- •7.10 Равновесия в реакциях ионного обмена
- •Гидролиз солей
- •8.1 Общие представления о гидролизе солей
- •8.2 Константа гидролиза
- •8.3 Степень гидролиза соли; её связь с константой гидролиза
- •8.4 Гидролиз солей, образованных многозарядными катионами и анионами
- •8.5 Смещение равновесия гидролиза
- •8.6 Соли, взаимно усиливающие гидролиз друг друга
- •8.7 Кислые гидролизующиеся соли
- •Электрохимические процессы
- •9.1 Понятие об электродном потенциале
- •9.2 Понятие о гальваническом элементе
- •9.3 Теория электродных потенциалов; уравнение Нернста
- •9.4 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •9.5 Электролиз
- •9.5.1 Электролиз расплавов
- •9.5.2 Электролиз водных растворов
- •9.5.3 Применение электролиза в промышленности
- •9.6 Понятие о контактной коррозии металлов
- •Литература
- •Часть 1 Общие вопросы химии
2.5.2 Солеобразные оксиды
В разделе 2.2 уже было отмечено, что такие соединения как Fe3O4 – оксид железа (II,III), Pb2O3, Pb3O4 – оксиды свинца (II,IV), Mn3O4 – оксид марганца (II,IV), относятся к солям.
F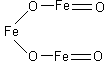 e3O4,
т.е. Fe(FeO2)2
– соль метажелезистой кислоты (HFeO2)
– метаферрит железа (II).
e3O4,
т.е. Fe(FeO2)2
– соль метажелезистой кислоты (HFeO2)
– метаферрит железа (II).
P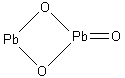 b2O3
, т.е. PbPbO3
– соль метасвинцовой кислоты (H2PbO3)
– метаплюмбат свинца (II).
b2O3
, т.е. PbPbO3
– соль метасвинцовой кислоты (H2PbO3)
– метаплюмбат свинца (II).
P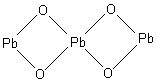 b3O4,
т.е. Pb2PbO4
– соль ортосвинцовой кислоты (H4PbO4)
– ортоплюмбат свинца (II).
b3O4,
т.е. Pb2PbO4
– соль ортосвинцовой кислоты (H4PbO4)
– ортоплюмбат свинца (II).
M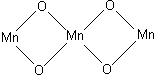 n3O4,
т.е. Mn2MnO4
– соль ортомарганцоватистой кислоты
(H4MnO4)
– ортоманганит марганца (II).
n3O4,
т.е. Mn2MnO4
– соль ортомарганцоватистой кислоты
(H4MnO4)
– ортоманганит марганца (II).
M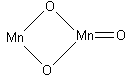 n2O3,
т.е. MnMnO3
– соль метаформы марганцоватистой
кислоты (H2MnO3)
– метаманганит марганца (II).
n2O3,
т.е. MnMnO3
– соль метаформы марганцоватистой
кислоты (H2MnO3)
– метаманганит марганца (II).
2.5.3 Диссоциация солей в водных растворах
Подавляющее большинство солей – сильные электролиты, которые в водных растворах диссоциируют на катион(ы) и анион(ы) необратимо и полностью. Fe2(SO4)3 2 Fe3+ + 3 SO42–
AlOH(NO3)2 AlOH2+ + 2 NO3– Ca(H2PO4)2 Ca2+ + 2 H2PO4–
Катионы основных и анионы кислых солей далее диссоциируют по типу слабых электролитов, т.е. обратимо. H2PO4– ⇆ H+ + HPO42–
AlOH2+ ⇆ Al3+ + OH– HPO42– ⇆ H+ + PO43–
Л Е К Ц И Я 3
Стехиометрические законы химии
Раздел химии, в котором рассматриваются количественный состав веществ и количественные соотношения (массовые или объёмные) между реагирующими веществами, называется стехиометрией. Расчёты количественных соотношений между элементами в соединениях или между реагирующими веществами называются стехиометрическими расчётами. В их основе лежат стехиометрические законы, такие как закон постоянства состава, закон сохранения массы веществ, закон Авогадро и другие.
Закон постоянства состава утверждает, что соотношение между массами элементов, входящих в состав данного соединения, постоянно и не зависит от способа получения этого соединения. Следует заметить, что для веществ с молекулярной структурой данный закон выполняется всегда. Однако, для ряда соединений (соединения переменного состава), которые имеют не молекулярную, а атомную структуру, этот закон часто не выполняется.
Согласно закону сохранения массы, установленному М.В. Ломоносовым, масса веществ, вступающих в реакцию, равна массе веществ, образующихся после реакции.
Важнейшими количественными параметрами, которые используются в стехиометрических расчётах, являются масса атома (атомная масса) и масса молекулы (молекулярная масса). В связи с неудобством выражения атомных и молекулярных масс в граммах и других единицах измерения, используемых при изучении объектов макромира, в химии и физике была принята шкала относительных атомных масс. В этой шкале единицей измерения является атомная единица массы (а.е.м.). Атомная единица массы представляет собой 1/12 массы атома изотопа углерода 12С. В соответствии с этим относительной атомной массой Ar элемента называют отношение массы атома этого элемента к 1/12 массы атома 12С. Масса молекулы, выраженная в атомных единицах массы, называется относительной молекулярной массой Mr. Так как масса молекулы любого вещества равна сумме масс атомов, образующих эту молекулу, то относительная молекулярная масса равна сумме соответствующих относительных атомных масс.
Строго говоря, для веществ с немолекулярной структурой понятие «молекулярная масса» не вполне логично, поскольку не всегда корректно говорить, например, о молекуле NaCl. В таких случаях термин «молекулярная масса» иногда заменяют понятием «формульная масса». Вместе с тем, термин «молекулярная масса» очень часто применяют и для веществ с немолекулярной структурой, условно предполагая существование соответствующих молекул.
Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является количество вещества. Количество некоторого вещества X обозначается n(X). Основной единицей измерения количества вещества является моль.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12C.
Выражая количество вещества в молях, необходимо в каждом конкретном случае точно указывать, какие именно структурные единицы имеются в виду. Выражение «1 моль водорода» является неточным; более точно следует сказать: «1 моль молекул водорода», или «1 моль атомов водорода», или «1 моль ионов водорода». Использующиеся высказывания типа «1 моль серной кислоты» допустимы, если однозначно подразумеваются структурные единицы: серная кислота – сложное вещество с молекулярной структурой и в данном случае однозначно подразумевается 1 моль молекул серной кислоты.
Из определения понятия «моль» следует, что в 1 моле любого вещества содержится одно и то же число структурных единиц (атомов, молекул, ионов). Это число называется числом Авогадро (Na); для практических расчётов его принимают приблизительно равным 6,02·1023 моль–1. Умножая число Авогадро Na на количество вещества n можно рассчитать число молекул N, содержащихся в любом количестве вещества. Для некоторого вещества X число молекул N(X) можно рассчитать по формуле
N(X) = Na · n(X) . (3.1)
Масса одного моля некоторого вещества Х называется молярной массой M(X) этого вещества. Зная молярную массу некоторого вещества X, можно рассчитать количество этого вещества по формуле
![]()
, (3.2)
где m(X) – масса вещества X.
Молярная масса имеет размерность г/моль.
Важно понимать, что молярная масса данного вещества численно равна относительной молекулярной массе этого вещества. Однако относительная молекулярная масса Mr характеризует массу микрочастицы – молекулы – и измеряется в атомных единицах массы, в то время как молярная масса M – это характеристика макроскопической величины – массы 1 моля вещества.
Согласно закону Авогадро в равных объёмах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одно и то же число молекул. С другой стороны, 1 моль любого вещества по определению содержит одинаковое число частиц. Следовательно, 1 моль любого газа в одних и тех же условиях занимает один и тот же объём. По аналогии с понятием молярной массы можно ввести понятие молярного объёма. Молярный объём Vm(X) некоторого вещества X – это объём одного моля этого вещества. Зная объём вещества V(X) и его молярный объём, можно рассчитать количество вещества по формуле
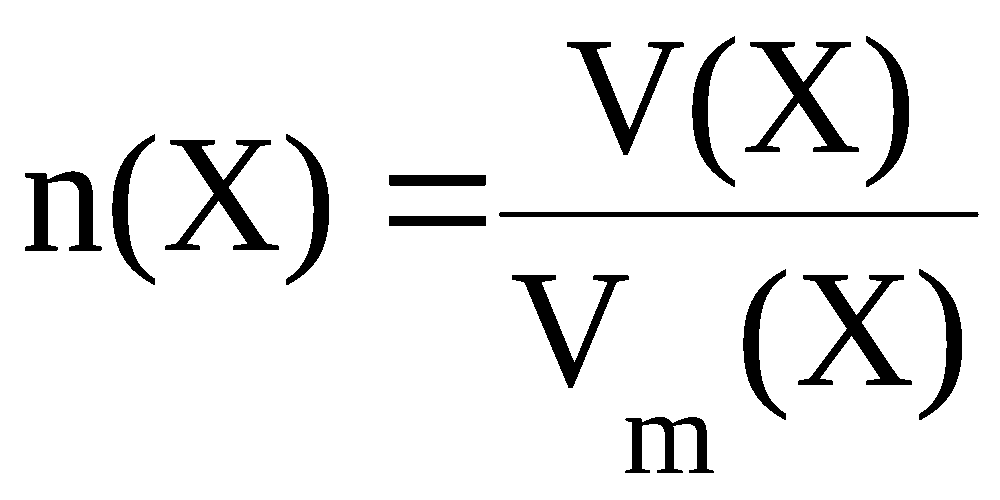
. (3.3)
1 моль любого газообразного вещества при нормальных условиях (температура 0С и давление 1 атмосфера) занимает объём, равный 22,4 л. Таким образом, при нормальных условиях Vm(газа) = 22,4 л/моль.
Знание молярных масс веществ и числа Авогадро позволяет, в случае необходимости, выразить массу молекулы любого вещества в граммах. Ниже приводится пример расчёта массы молекулы водорода.
1 моль водорода содержит 6,02·1023 молекул H2 и имеет массу 2 г (т.к. M(H2) = 2 г/моль). Следовательно,
6,02·1023 молекул H2 имеют массу 2 г;
1 молекула H2 имеет массу x г; x = 3,32·10–24 г .
Понятие «моль» широко используется для проведения расчётов по уравнениям химических реакций, поскольку в любом уравнении химической реакции стехиометрические коэффициенты показывают, в каких молярных соотношениях вещества реагируют друг с другом и образуются в результате реакции. Например, уравнение реакции 4 NH3 + 3 O2 2 N2 + 6 H2O содержит следующую информацию: 4 моль аммиака реагируют без избытка и недостатка с 3 моль кислорода, при этом образуется 2 моль азота и 6 моль воды. Таким образом, в любом уравнении химической реакции реагирующие и образующиеся вещества связаны чёткими молярными соотношениями. Это и позволяет проводить расчёты по уравнениям реакций: если известно число моль одного прореагировавшего или образовавшегося вещества, то из уравнения реакции можно получить информацию о количестве любого другого вещества, вступившего в реакцию или образовавшегося в результате её протекания.
Л Е К Ц И Я 4
