
- •Общая и неорганическая химия
- •Часть 1 общие вопросы химии
- •Содержание
- •Введение ..………………………………………………………..29
- •7.5 Расчёт концентраций ионов в растворах
- •Основные химические понятия
- •Основные классы неорганических соединений
- •2.1 Введение
- •2.2 Оксиды
- •2.3 Основания
- •2.4 Кислоты
- •2.4.1 Классификация кислот
- •2.4.2 Номенклатура кислот и их солей
- •Продолжение таблицы 2.1
- •2.5 Соли
- •2.5.1 Номенклатура средних, кислых и основных солей
- •2.5.2 Солеобразные оксиды
- •2.5.3 Диссоциация солей в водных растворах
- •Стехиометрические законы химии
- •Типы химических реакций
- •4.1 Введение
- •4.2 Реакции ионного обмена
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •4.3.2 Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
- •2 Cu(oh)2 Cu2o hcho co2
- •Понятие о химическом равновесии
- •Количественной характеристикой системы в состоянии химического равновесия является константа равновесия k.
- •5.2 Смещение химического равновесия. Принцип Ле-Шателье
- •5.3 Основные типы задач на химическое равновесие
- •Общие свойства растворов
- •6.1 Характеристика растворов. Процесс растворения
- •6.2 Способы выражения концентрации растворов
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •6.3 Растворимость
- •Растворы электролитов
- •7.1 Основные положения теории электролитической диссоциации
- •7.2 Степень диссоциации
- •7.3 Константа диссоциации
- •7.4 Расчёт концентраций ионов в растворах сильных электролитов
- •7.5 Расчёт концентраций ионов в растворах слабых электролитов
- •7.6 Закон разбавления Оствальда
- •7.7 Диссоциация воды. Водородный показатель
- •7.8 Понятие о буферных растворах
- •7.9 Произведение растворимости
- •0,1 Моль/л 0,1
- •7.10 Равновесия в реакциях ионного обмена
- •Гидролиз солей
- •8.1 Общие представления о гидролизе солей
- •8.2 Константа гидролиза
- •8.3 Степень гидролиза соли; её связь с константой гидролиза
- •8.4 Гидролиз солей, образованных многозарядными катионами и анионами
- •8.5 Смещение равновесия гидролиза
- •8.6 Соли, взаимно усиливающие гидролиз друг друга
- •8.7 Кислые гидролизующиеся соли
- •Электрохимические процессы
- •9.1 Понятие об электродном потенциале
- •9.2 Понятие о гальваническом элементе
- •9.3 Теория электродных потенциалов; уравнение Нернста
- •9.4 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •9.5 Электролиз
- •9.5.1 Электролиз расплавов
- •9.5.2 Электролиз водных растворов
- •9.5.3 Применение электролиза в промышленности
- •9.6 Понятие о контактной коррозии металлов
- •Литература
- •Часть 1 Общие вопросы химии
Электрохимические процессы
9.1 Понятие об электродном потенциале
Опыты с применением радиоактивных изотопов показывают, что при погружении любого металла, химически не реагирующего с водой, в раствор соли этого металла, между металлической фазой и раствором соли происходит обмен ионами. Ионы металла Mez+ переходят из кристаллической решётки металла в раствор и обратно. В первый момент после установления контакта между металлом и раствором скорости прямого и обратного процессов различны. Если преобладает переход ионов из металлической фазы в раствор, то раствор приобретает положительный заряд, а металл (т.е. металлический электрод) заряжается отрицательно. По мере увеличения этого заряда скорость перехода катионов металла в одноимённо заряженный раствор уменьшается. Напротив, скорость перехода катионов металла из раствора на отрицательно заряженный металлический электрод увеличивается. В итоге скорости обоих процессов выравниваются, и между металлом и раствором устанавливается химическое равновесие:
Mez+(металлическая фаза) ⇆ Mez+(раствор) .
При этом металлический электрод оказывается заряженным отрицательно, а раствор – положительно.
Если при установлении контакта металл-раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то в этом случае к моменту наступления равновесия металлический электрод окажется заряженным положительно, а раствор – отрицательно.
Таким образом, между металлом и раствором его соли возникает скачок потенциалов. Потенциал металлического электрода, отвечающий равновесию между металлической фазой и раствором, называется равновесным электродным потенциалом.
9.2 Понятие о гальваническом элементе
Н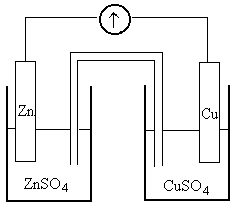 а
двух различных металлических электродах
(например, цинковом и медном), погружённых
в растворы своих солей, возникают
различные по величине потенциалы. При
замыкании металлическим проводником
цинковой и медной пластинок в цепи
появляется направленное движение
электронов от электрода с более
отрицательным потенциалом (т.е. от
электрода с большей концентрацией
электронов) к электроду с более
положительным потенциалом. В
рассматриваемом случае более отрицательным
потенциалом обладает цинковый электрод,
более положительным – медный.
Электрический контакт между растворами
обеспечивается с помощью солевого
мостика – трубки, заполненной раствором
хлорида калия.
а
двух различных металлических электродах
(например, цинковом и медном), погружённых
в растворы своих солей, возникают
различные по величине потенциалы. При
замыкании металлическим проводником
цинковой и медной пластинок в цепи
появляется направленное движение
электронов от электрода с более
отрицательным потенциалом (т.е. от
электрода с большей концентрацией
электронов) к электроду с более
положительным потенциалом. В
рассматриваемом случае более отрицательным
потенциалом обладает цинковый электрод,
более положительным – медный.
Электрический контакт между растворами
обеспечивается с помощью солевого
мостика – трубки, заполненной раствором
хлорида калия.
У
Рис. 9.1 – Гальванический элемент
Даниэля-Якоби.
ся к положительному (медному) электроду, где
протекает процесс восстановления: Cu2+ + 2e– Cu.
Таким образом, в гальваническом элементе Даниэля-Якоби протекает реакция окисления цинка и восстановления ионов меди:
Zn + Cu2+ Zn2+ + Cu;
Zn + CuSO4 ZnSO4 + Cu .
Эту реакцию можно было бы провести и по-другому, приведя в непосредственное соприкосновение металлический цинк и раствор сульфата меди. Но в этом случае окислительно-восстановительная реакция протекала бы без пространственного разделения процессов окисления и восстановления и не могла бы быть использована для получения электрической энергии. Электрохимические реакции являются частным случаем окислительно-восстановительных реакций и всегда протекают с пространственным разделением процессов окисления и восстановления.
Электрод, на котором протекает окисление, называется анодом, а процесс окисления – анодным процессом. Электрод, на котором протекает восстановление, называется катодом, а процесс восстановления – катодным процессом. Как уже было ранее сказано, анод гальванического элемента заряжен более отрицательно, чем катод, поэтому заряд анода гальванического элемента обозначают знаком «минус», а заряд катода – знаком «плюс».
Устройство любого гальванического элемента можно представить схемой. Например, устройство гальванического элемента Даниэля-Якоби выражается схемой (-) анод Zn ZnSO4 CuSO4 Cu катод (+) .
В этой схеме одной вертикальной чертой обозначен контакт металла с раствором, двумя вертикальными чертами – контакт между растворами. Разность равновесных электродных потенциалов () катода и анода гальванического элемента называется электродвижущей силой (ЭДС) гальванического элемента (E).
E = катода - анода (9.1)
