
- •Общая и неорганическая химия
- •Часть 1 общие вопросы химии
- •Содержание
- •Введение ..………………………………………………………..29
- •7.5 Расчёт концентраций ионов в растворах
- •Основные химические понятия
- •Основные классы неорганических соединений
- •2.1 Введение
- •2.2 Оксиды
- •2.3 Основания
- •2.4 Кислоты
- •2.4.1 Классификация кислот
- •2.4.2 Номенклатура кислот и их солей
- •Продолжение таблицы 2.1
- •2.5 Соли
- •2.5.1 Номенклатура средних, кислых и основных солей
- •2.5.2 Солеобразные оксиды
- •2.5.3 Диссоциация солей в водных растворах
- •Стехиометрические законы химии
- •Типы химических реакций
- •4.1 Введение
- •4.2 Реакции ионного обмена
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •4.3.2 Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
- •2 Cu(oh)2 Cu2o hcho co2
- •Понятие о химическом равновесии
- •Количественной характеристикой системы в состоянии химического равновесия является константа равновесия k.
- •5.2 Смещение химического равновесия. Принцип Ле-Шателье
- •5.3 Основные типы задач на химическое равновесие
- •Общие свойства растворов
- •6.1 Характеристика растворов. Процесс растворения
- •6.2 Способы выражения концентрации растворов
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •6.3 Растворимость
- •Растворы электролитов
- •7.1 Основные положения теории электролитической диссоциации
- •7.2 Степень диссоциации
- •7.3 Константа диссоциации
- •7.4 Расчёт концентраций ионов в растворах сильных электролитов
- •7.5 Расчёт концентраций ионов в растворах слабых электролитов
- •7.6 Закон разбавления Оствальда
- •7.7 Диссоциация воды. Водородный показатель
- •7.8 Понятие о буферных растворах
- •7.9 Произведение растворимости
- •0,1 Моль/л 0,1
- •7.10 Равновесия в реакциях ионного обмена
- •Гидролиз солей
- •8.1 Общие представления о гидролизе солей
- •8.2 Константа гидролиза
- •8.3 Степень гидролиза соли; её связь с константой гидролиза
- •8.4 Гидролиз солей, образованных многозарядными катионами и анионами
- •8.5 Смещение равновесия гидролиза
- •8.6 Соли, взаимно усиливающие гидролиз друг друга
- •8.7 Кислые гидролизующиеся соли
- •Электрохимические процессы
- •9.1 Понятие об электродном потенциале
- •9.2 Понятие о гальваническом элементе
- •9.3 Теория электродных потенциалов; уравнение Нернста
- •9.4 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •9.5 Электролиз
- •9.5.1 Электролиз расплавов
- •9.5.2 Электролиз водных растворов
- •9.5.3 Применение электролиза в промышленности
- •9.6 Понятие о контактной коррозии металлов
- •Литература
- •Часть 1 Общие вопросы химии
8.2 Константа гидролиза
Гидролиз солей в большинстве случаев протекает обратимо. Поэтому для процесса гидролиза, как и любого равновесного процесса можно записать выражение константы равновесия. Константа равновесия в данном случае называется константой гидролиза.
Для соли, гидролизующейся по катиону Me+ + HOH ⇆ MeOH + H+
![]() .
(8.1)
.
(8.1)
Поскольку в разбавленных водных растворах концентрация воды постоянна (см. раздел 7.7 предыдущей лекции), то её не записывают в выражении константы гидролиза. Формулу 8.1 можно преобразовать, выразив концентрацию ионов водорода из уравнения ионного произведения воды C(H+)·C(OH–) = Kw .
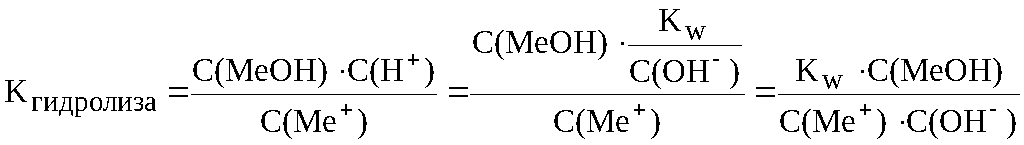
В![]() ыражение
есть ни что иное, как величина, обратная
ыражение
есть ни что иное, как величина, обратная
константе диссоциации слабого основания KMeOH . Таким образом, окончательно получается следующее уравнение для расчёта константы гидролиза соли, гидролизующейся по катиону:
![]()
. (8.2)
Это уравнение показывает, что константа гидролиза соли, гидролизующейся только по катиону тем больше, чем меньше константа диссоциации основания, которым образована соль. Это означает, что соль гидролизуется тем сильнее, чем более слабым основанием, она образована.
Можно также показать, что для соли гидролизующейся только по аниону An– + HOH ⇆ HAn + OH– константа гидролиза
![]()
(8.3)
может быть вычислена по следующему уравнению, аналогичному уравнению 8.2:
![]()
. (8.4)
В формуле 8.4 KHAn – константа диссоциации слабой кислоты, которой образована соль. Последнее уравнение показывает, что Kгидролиза тем больше, чем меньше KHAn, т.е. гидролиз по аниону протекает тем сильнее, чем слабее кислота, которой образована соль.
Ниже приводится вывод формулы константы гидролиза для соли, гидролизующейся одновременно и по катиону, и по аниону.
Me+ + An– + HOH ⇆ MeOH + HAn.
![]() (8.5)
(8.5)
Уравнение 8.5 можно преобразовать, умножая и числитель, и знаменатель на константу ионного произведения воды.
![]()
![]()
![]() (8.6)
(8.6)
8.3 Степень гидролиза соли; её связь с константой гидролиза
Отношение концентрации соли, подвергшейся гидролизу к общей концентрации соли в растворе называется степенью гидролиза соли.
![]()
(8.7)
В формуле 8.7 h – степень гидролиза;
Cгидр. – концентрация соли, подвергшейся гидролизу;
C0 – общая концентрация соли в растворе .
П
x
C0-x
x
Me+ + HOH ⇆ MeOH + H+
![]()
Если гидролиз соли протекает в небольшой степени, то «иксом» в знаменателе последнего выражения можно пренебречь, поскольку C0 >> x.
![]()
![]() (8.8 а)
(8.8 а)
П![]() оскольку
x
= C(H+),
эта формула применима для расчёта
концентрация ионов водорода в растворе
соли, гидролизующейся по катиону.
оскольку
x
= C(H+),
эта формула применима для расчёта
концентрация ионов водорода в растворе
соли, гидролизующейся по катиону.
(8.8 б)
Ниже приведён вывод формулы для степени гидролиза соли, гидролизующейся по катиону.
![]()
![]() (8.9)
(8.9)
Можно также показать, что концентрацию ионов OH– в растворе соли, гидролизующейся только по аниону, можно вычислить по формуле
, (8.10)
которая
аналогична уравнению 8.8 б.![]()
Степень гидролиза соли, гидролизующейся по аниону, также как и степень гидролиза соли, гидролизующейся по катиону, вычисляется по формуле 8.9.
Как видно из полученных формул, степень гидролиза соли, гидролизующейся только по катиону, или только по аниону тем больше, чем меньше концентрация соли, т.е. степень гидролиза такой соли увеличивается с разбавлением раствора.
Степень гидролиза соли, гидролизующейся одновременно и по катиону, и по аниону Me+ + An– + HOH ⇆ MeOH + HАn ,
не зависит от концентрации раствора. Если общая концентрация этой соли в растворе равна C0 моль/л, а концентрация соли, подвергшейся гидролизу равна x моль/л, то в результате гидролиза образуется x моль/л основания MeOH и x моль/л кислоты HAn; концентрация соли, не подвергшейся гидролизу, будет равна C0-x моль/л.
M
x
x
С0-x
С0-x
![]()
![]() (8.11)
(8.11)
