- •1. Фотоэффект. Законы фотоэффекта. Уравнение Эйнштейна для фотоэффекта.
- •2. Эффект Комптона.
- •3. Свойства фотонов. Флуктуации интенсивности светового потока.
- •4. Поляризация фотонов. Интерференция фотонов.
- •5. Дифракция рентген-х лучей в кристаллах. Методы исслед дифракции: способы Лауэ, Брэгга и Дебая-Шерера.
- •6. Законы излучения абсолютно черного тела, формула Планка.
- •7. Понятие волн де Бройля. Уравнения де Бройля.
- •8. Эксперименты по волновой природе элементарных частиц.
- •10) Опыты Резерфорда, планетарная модель атома, заряд ядра, распределение зарядов в атоме
- •11) Постулаты Бора, правила квантования: Структура спектральных термов атома водорода, спектральные серии.
- •12. Изотопический сдвиг спектральных линий.
- •13. Квантовомеханические операторы, их свойства, собственные значения и собственные функции.
- •14. Постулаты квантовой механики и описание динамических переменных с помощью операторов.
- •15. Условие одновременной измеримости различных динамических переменных. Соотношение неопределенностей.
- •16. Частица в одномерной прямоугольной потенциальной яме с абсолютно непроницаемыми стенками.
- •19. Магнитные и механические моменты атома, векторная модель атома, гиромагнитное отношение и фактор Ланде
- •Эффект Зеемана.
- •Нормальный эффект Зеемана
- •Эффект Пашена-Бака.
- •22. Эффект Штарка.
- •Электронные конфигурации, принципы заполнения электронных оболочек атомов, правило Хунда.
10) Опыты Резерфорда, планетарная модель атома, заряд ядра, распределение зарядов в атоме
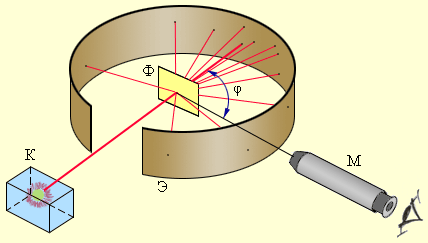
Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
|
Рисунок 6.1.2.Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп. |
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны (рис. 6.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
|
|
11) Постулаты Бора, правила квантования: Структура спектральных термов атома водорода, спектральные серии.
Бор проанализировал всю совокупность опытных фактов, и пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
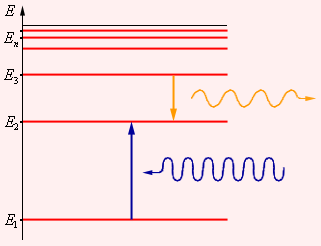
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию. Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
|
Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов |
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
|
правила
квантования
-
Третий постулат Н. Бора определяет
правила квантования стационарных орбит.
Бор предположил, что момент импульса
электрона, вращающегося на стационарной
орбите в атоме водорода, может принимать
только дискретные значения, кратные
постоянной Планка. Для круговых орбит
правило квантования Бора записывается
в виде:
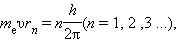 где mе – масса электрона, υ – его
орбитальная скорость, rn
– радиус n-ой стационарной орбиты. Целое
число n называется квантовым числом.
Правило квантования орбит по Бору
получило наглядную интерпретацию в
теории де Бройля, высказавшего гипотезу
о наличии у электрона волновых свойств
(1924 г.). Согласно де Бройлю электрону (и
любому другому микрообъекту) соответствует
волновой процесс с длиной волны
где mе – масса электрона, υ – его
орбитальная скорость, rn
– радиус n-ой стационарной орбиты. Целое
число n называется квантовым числом.
Правило квантования орбит по Бору
получило наглядную интерпретацию в
теории де Бройля, высказавшего гипотезу
о наличии у электрона волновых свойств
(1924 г.). Согласно де Бройлю электрону (и
любому другому микрообъекту) соответствует
волновой процесс с длиной волны
![]() где p – импульс электрона.
где p – импульс электрона.
В применении к орбитальному движению электрона на стационарной круговой орбите в атоме водорода из правила квантования Бора вытекает соотношение nλ = 2π rn.
Это означает, что длина волны де Бройля целое число раз укладывается на длине стационарной круговой орбиты электрона, то есть стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты.
Компьютерная модель является качественной иллюстрацией идеи де Бройля возникновения стоячих волн на стационарных орбитах.
Модель позволяет, плавно изменяя радиус, выбирать стационарные орбиты, на длине которых укладывается целое число длин волн де Бройля и образуется стоячая волна.
Компьютерная модель на примере орбит с квантовыми числами n = 2, 3 и 4 иллюстрирует закономерность, которой подчиняются радиусы стационарных круговых орбит в атоме водорода. Согласно теории Бора rn = n2 *r1,
где r1 = 5,29·10–11 м – радиус первой боровской орбиты.