
- •Г.О.Самара 2012 «Общая и неорганическая химия» Открытие строения атома э.Резерфордом
- •Жизнь и деятельность д.И. Менделеева
- •Применение неорганических полимеров медицине Гидратная теория растворов д.И.Менделеева
- •Аллотропные модификации химических элементов кислорода, серы. Фосфора, углерода. Их применение в медицине.
- •Химические вещества в повседневной жизни человека.
- •«Органическая химия» Жизнь и деятельность а.М. Бутлерова
- •Применение парафиновых углеводородов в медицине
- •Синтетические каучуки: история, многообразие и перспективы
- •Токсическое действие бензола и толуола на организм человека.
- •Нефть и ее транспортировка как основа взаимовыгодного международного сотрудничества.
- •Этанол: величайшее благо и зло.
- •Гидратация этилена
- •Очистка этанола
- •Абсолютный спирт
- •Многоатомные спирты и моя будущая профессия.
- •Формальдегид как основа получения других веществ.
- •Химические свойства
- •Получение
- •Безопасность и токсические свойства
- •Воздействие на организм и симптомы хронического отравления
- •Канцерогенность
- •Применение
- •Использование в качестве консерванта
- •История уксуса.
- •Сложные эфиры и жиры в жизни человека. Глюкоза - ценное питательное вещество.
- •Амины- бескислородные основания.
- •Некоторые наиболее известные амины
- •Аминокислоты-«кирпичики» белковых молекул.
- •Биологические функции белков.
- •Гетероциклические функции белков и их медико-биологическое значение.
- •Химия и биология нуклеиновых кислот.
- •БаДы и их влияние на здоровье человека.
- •Витамины.
Аллотропные модификации химических элементов кислорода, серы. Фосфора, углерода. Их применение в медицине.
Элемент кислород образует две аллотропные модификации: кислород О2 и озон О3. (аллотропия – это способность атома одного элемента образовывать несколько простых веществ.). озон более сильный окислитель, чем кислород. Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел. В атмосфере Земли озоновый слой (на высоте 25 – 30 км) защищает живой мир от космического УФ-излучения. Слой разрушается под воздействием оксидов азота.
Сера образует несколько аллотропных модификаций. Наиболее распространенной является ромбическая сера, состоящая из коронообразных восьмиатомных молекул и образующая ромбоэдральные кристаллы. Она представляет собой твёрдое вещество жёлтого цвета, нерастворимое в воде, в воде не смачиваемое (плавает на поверхности), что используется при её добыче. Ромбическая сера плохо проводит тепло и электричество. Нерастворима в воде, но растворяется в органических растворителях. Лучшим её растворителем является сероуглерод(CS2).
Также существуют ещё две аллотропные модификации серы: моноклинная и пластическая. Моноклинная представляет собой тёмно-жёлтые иглы, а пластическая-коричневую резиноподобную (аморфную) массу, которая образуется, если расплавленную серу вылить в холодную воду. Структура пластической серы представляет собой длинные полимерные цепи, длина которых зависит от условий получения вещества.
При комнатной (или близкой к комнатной) температуре эти модификации превращаются в ромбическую.
Свойства первых двух модификаций приведены в таблице:
модификация |
плотность (кг/м3) |
tплавл 0С |
ромбическая |
2070 |
112,8 |
моноклинная |
1960 |
119 |
|
|
|
Фосфор образует несколько аллотропных видоизменений – модификаций. Явление аллотропных модификаций у фосфора вызвано образованием различных кристаллических форм. Белый фосфор (Р4) имеет молекулярную кристаллическую решетку, красный и черный – атомную. Различие в строении кристаллической решетки обуславливает и различие в их физических и химических свойствах. Белый фосфор – сильный яд, даже в малых дозах действует смертельно. В твердом состоянии получается при быстром охлаждении паров фосфора. В чистом виде совершенно бесцветен, прозрачен, по внешнему виду похож на воск: на холоде хрупок, при температуре выше 15 °C – мягкий, легко режется ножом; в воде нерастворим, но хорошо растворяется в сероуглероде – СS2 и в органических растворителях; легко плавится, летуч. Прочность связи в молекуле невелика, чем обусловлена высокая химическая активность. Белый фосфор быстро окисляется на воздухе, при этом светится в темноте – превращение химической энергии в световую; самовоспламеняется на воздухе, при слабом нагревании, незначительном трении. С кислородом реагирует без поджигания, даже под водой, образуя сначала Р2О3, затем P2O5:
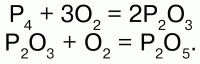
При длительном нагревании белый фосфор превращается в красный. Белый фосфор применяется для изготовления боеприпасов артиллерийских снарядов, авиабомб, предназначенных для образования дымовых завес. Широкого применения не имеет.
Красный фосфор – порошок красно-бурого цвета, неядовит, нелетуч, нерастворим в воде и во многих органических растворителях и сероуглероде; не воспламеняется на воздухе и не светится в темноте. Только при нагревании до 260 °C воспламеняется. При сильном нагревании, без доступа воздуха, не плавясь (минуя жидкое состояние) испаряется – сублимируется. При охлаждении превращается в белый фосфор. Идет на изготовление спичек: красный фосфор в смеси с сульфидом сурьмы, железным суриком, с примесью кварца и клея наносят на поверхность спичечной коробки. Головка спичек состоит в основном из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево. Также красный фосфор применяется в приготовлении фармацевтических препаратов.
Черный фосфор получается при сильном нагревании и при высоком давлении белого фосфора. Черный фосфор тяжелее других модификаций. Применяется очень редко – как полупроводник в составе фосфата галлия и индия в металлургии.
Углерод (лат. carboneuia) известен с глубокой древности. В земной коре его содержится примерно 0,35% по массе. В природе углерод встречается в свободном и связанном состоянии, главным образом в виде карбонатов (мел, известняк, мрамор), в каменных и бурых углях, торфе. Углерод входит в состав нефти, природного газа, воздуха, растений, организмов человека и животных. Его соединения составляют основу живой природы - флоры и фауны. Атом углерода имеет 6 электронов, 2 на внутреннем слое (1s2), а 4 (2s22р2) - на внешнем. С наиболее активными металлами углерод проявляет степень окисления -4. Углерод способен соединяться между собой с образованием прочных длинных цепей. В отличие от кислорода и азота углерод при обычных условиях не образует молекул, у него атомная кристаллическая решетка. Существуют четыре аллотропных модификации углерода: алмаз, графит, карбин и букибол. Кристаллическая решетка алмаза состоит из атомов углерода, соединенных между собой очень прочными s-связями. В кристалле алмаза все связи эквивалентны и атомы образуют трехмерный каркас из сочлененных тетраэдров. Алмаз - самое твердое вещество, найденное в природе. Графит представляет собой темно-серое с металлическим блеском, мягкое, жирное на ощупь вещество. Хорошо проводит электрический ток. В графите атомы углерода расположены в параллельных слоях, образуя гексагональную сетку. Внутри слоя атомы связаны гораздо сильнее, чем один слой с другим, поэтому свойства графита сильно различаются по разным направлениям. Карбин - получен искусственным путем. Существует два вида карбина: поликумулен =С=С=С=С= и полиин -C=C-C=C-C=C-. Букибол - получен в 1985г., имеет сферическую форму (как футбольный мяч), состоит из 60 или 70 атомов углерода. Углерод в виде сажи, кокса, древесного угля, костных углей широко используется в металлургии, синтезе органических веществ, как топливо, в быту.
