
- •Г.О.Самара 2012 «Общая и неорганическая химия» Открытие строения атома э.Резерфордом
- •Жизнь и деятельность д.И. Менделеева
- •Применение неорганических полимеров медицине Гидратная теория растворов д.И.Менделеева
- •Аллотропные модификации химических элементов кислорода, серы. Фосфора, углерода. Их применение в медицине.
- •Химические вещества в повседневной жизни человека.
- •«Органическая химия» Жизнь и деятельность а.М. Бутлерова
- •Применение парафиновых углеводородов в медицине
- •Синтетические каучуки: история, многообразие и перспективы
- •Токсическое действие бензола и толуола на организм человека.
- •Нефть и ее транспортировка как основа взаимовыгодного международного сотрудничества.
- •Этанол: величайшее благо и зло.
- •Гидратация этилена
- •Очистка этанола
- •Абсолютный спирт
- •Многоатомные спирты и моя будущая профессия.
- •Формальдегид как основа получения других веществ.
- •Химические свойства
- •Получение
- •Безопасность и токсические свойства
- •Воздействие на организм и симптомы хронического отравления
- •Канцерогенность
- •Применение
- •Использование в качестве консерванта
- •История уксуса.
- •Сложные эфиры и жиры в жизни человека. Глюкоза - ценное питательное вещество.
- •Амины- бескислородные основания.
- •Некоторые наиболее известные амины
- •Аминокислоты-«кирпичики» белковых молекул.
- •Биологические функции белков.
- •Гетероциклические функции белков и их медико-биологическое значение.
- •Химия и биология нуклеиновых кислот.
- •БаДы и их влияние на здоровье человека.
- •Витамины.
Многоатомные спирты и моя будущая профессия.
Важнейшие из многоатомных спиртов - этиленгликоль и глицерин:
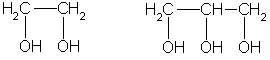
этиленгликоль глицерин
Это — вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение.
1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):
ClCH2-CH2Cl + 2NaOH → НОСН2-СН2ОН + 2NaCl.
2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия:
СН2=СН2 + [О] + Н2О → НOСН2-СН2ОН.
3. Глицерин получают гидролизом жиров.
Химические свойства. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты — более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко, синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди:
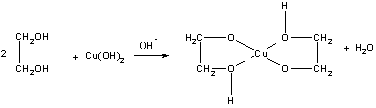
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NO2непосредственно связана с атомом углерода):
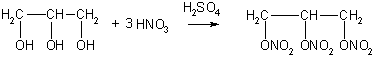
Применение. Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах он используется также для получения диоксана, важного (хотя и токсичного) лабораторного растворителя. Диоксан получают межмолекулярной дегидратацией этиленгликоля:
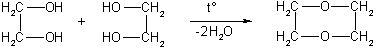
диоксан
Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Формальдегид как основа получения других веществ.
Формальдегид (от лат. formīca «муравей») — бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, токсичен.
Формальдегид — первый член гомологического ряда алифатических альдегидов, альдегидмуравьиной кислоты.
Физические свойства
Величина |
Значение |
Ст. энергия Гиббса образования ΔG |
−110 кДж/моль (г) |
Ст. энтропия образования S |
218,66 Дж/моль·K (г) |
Ст. мольная теплоёмкость Cp |
35,35 Дж/моль·K (г) |
Энтальпия кипения ΔHкип |
23,3 кДж/моль |
|
|
