
- •Введение
- •Раздел «Химическая термодинамика»
- •Раздел «Химическое равновесие»
- •Раздел «Фазовые равновесия. Растворы»
- •Раздел «Электрохимия»
- •Раздел «Химическая кинетика. Катализ»
- •Библиографический список
- •Приложение
- •Термодинамические свойства некоторых веществ
- •Равновесие в системе
- •Алгоритм расчета термодинамических функций физико-химического процесса
Раздел «Химическая кинетика. Катализ»
Пример 11
Для некоторой реакции, протекающей по первому порядку n = 1, даны значения констант скоростей k при различных температурах
Таблица 7
Т, К |
556 |
629 |
666 |
700 |
784 |
k, с-1 |
3,52 · 10-7 |
3,02 · 10-5 |
2,19 · 10-4 |
1,16 · 10-3 |
3,95 · 10-2 |
11.1.
Постройте графики зависимости k
= f(Т)
и lnk
= f![]() ;
;
11.2. Вычислите энергию активации этой реакции графически и аналитически.
Р е ш е н и е
11.1. Для построения графиков по данным табл. 7 (рис. 7, 8) выразим величины k с одинаковым множителем 10-4, посчитаем lnk и , полученные значения сведем в табл. 8.
11.2. Для определения энергии активации Е используем уравнение Аррениуса в интегральной логарифмической форме [2, с. 316].
Таблица 8
Т, К |
k, с-1 |
, К-1 |
lnk |
556 |
0,0035 · 10-4 |
1,8 · 10-3 |
-14,85 |
629 |
0,302 · 10-4 |
1,59 · 10-3 |
-10,41 |
666 |
2,19 · 10-4 |
1,50 · 10-3 |
-8,42 |
700 |
11,6 · 10-4 |
1,43 · 10-3 |
-6,76 |
784 |
395 · 10-4 |
1,21 · 10-3 |
-3,23 |
 k
· 104,
c-1
k
· 104,
c-1

400
300
200
100

Т,К
500 600 700 800
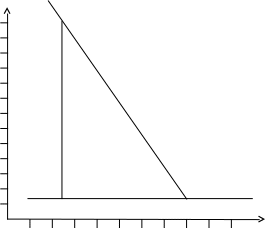
Рис. 7. График зависимости k = f(T)
Для графического определения Е используем уравнение в виде:
![]() ,
,
окуда вытекает,
что на графике в координатах lnk
= f
(рис. 8), тангенс угла наклона прямой
![]() .
.
Из графика находим,
что tg
=
![]() .
.
 lnk
lnk
- 5
а
- 10
 в
в
- 15
1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 2,0 · 103, К-1
Рис. 8. График зависимости lnk = f
![]() ,
откуда Е = tg
· R
= 23200 · 8,314 = 192884 Дж = 192,9
кДж.
,
откуда Е = tg
· R
= 23200 · 8,314 = 192884 Дж = 192,9
кДж.
Для аналитического определения Е используем данные табл. 7 и уравнение:
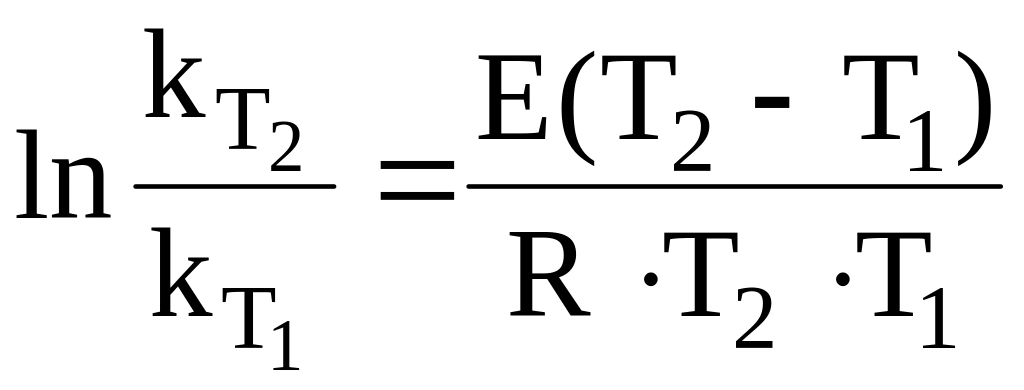 ,
откуда
,
откуда
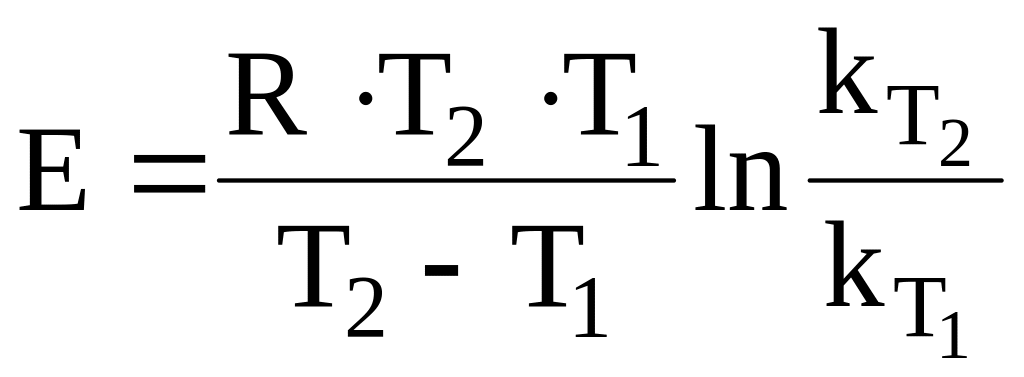 ;
;
Т1 = 556 К;
 =
3,52 · 10-7
с-1;
=
3,52 · 10-7
с-1;
Т2
= 666 К;
![]() =
2,19 · 10-4
с-1;
=
2,19 · 10-4
с-1;
![]() .
.
Т1 = 629 К; = 3,02 · 10-5 с-1;
Т2 = 784 К; = 3,95 · 10-2 с-1;
![]() .
.
Т1 = 700 К; = 1,16 · 10-3;
Т2 = 784 К; = 3,95 · 10-2;
![]() .
.
Находим среднее значение энергии активации:
![]() 187,2
кДж.
187,2
кДж.
Энергии активации, вычисленные графически и аналитически, практически одинаковы.
Пример 12
Для реакции 2NO2 N2 + 2O2
по значениям констант при двух температурах
Т1 = 986 К; k1 = 6,72 л·моль-1·мин-1.
Т2 = 1165 К; k2 = 977 л·моль-1·мин-1.
Определите
12.1. Энергию активации;
12.2. Константу скорости при Т3 = 1053 К;
12.3. Температурный коэффициент скорости реакции ;
12.4. Количество вещества, прореагировавшее при Т1 = 986 К за время t = 65 мин, если начальная концентрация С0 = 1,75 моль/л.
Примите порядок реакции равным молекулярности n = 2.
Р е ш е н и е
12.1. Энергию активации выражаем из интегральной логарифмической формы уравнения Аррениуса [2, с. 316]:
![]() .
.
12.2. Величину константы скорости k3 при температуре Т3 = 1053 К также выражаем из уравнения Аррениуса
![]() ;
;
![]() ;
;
K3 = е3,967 = 52,83 л · моль-1 · мин-1.
12.3. Температурный коэффициент скорости реакции выражаем из правила Вант-Гоффа [2, с. 314]:
![]() ;
;
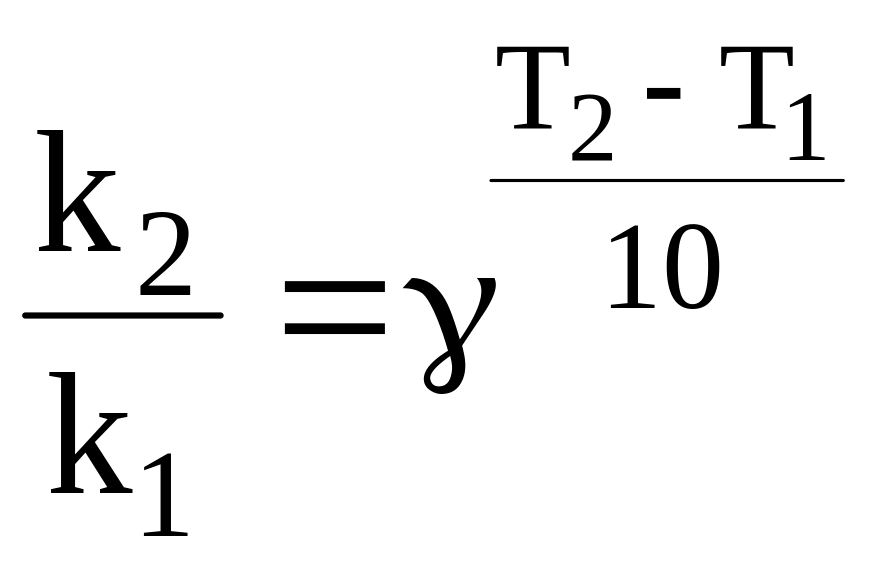 ;
;
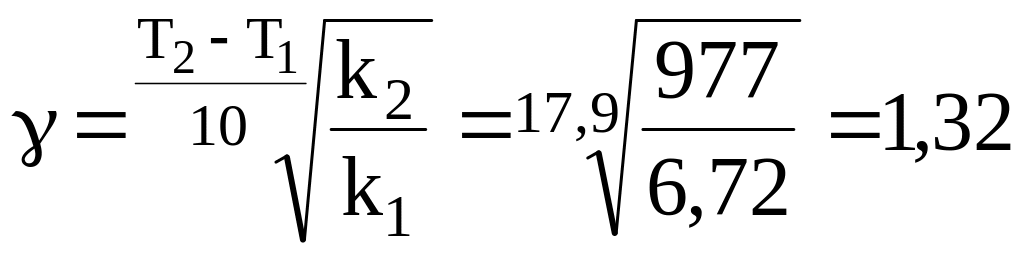 ,
,
где
![]() .
.
Величина температурного коэффициента меньше, чем по правилу Вант-Гоффа ( = 2 4).
12.4. Для реакции второго порядка [2, с. 302]
![]() ,
,
где х – количество вещества, прореагировавшее за время реакции t;
С0 – начальная концентрация исходного вещества.
Откуда выражаем величину х:
![]() .
.
По условию задачи k = 6,72 л · моль-1 · мин-1 при Т = 986 К; t = 65 мин; С0 = 1,75 моль/л.
Находим
![]() .
.
За 65 мин вещество NO2 практически полностью разложится при Т = 986 К.
Если порядок реакции первый n = 1, то для определения количества х, прореагировавшего за время реакции t следует воспользоваться кинетическим уравнением реакции первого порядка [2, с. 301]:
![]() .
.
