
- •Введение
- •Раздел «Химическая термодинамика»
- •Раздел «Химическое равновесие»
- •Раздел «Фазовые равновесия. Растворы»
- •Раздел «Электрохимия»
- •Раздел «Химическая кинетика. Катализ»
- •Библиографический список
- •Приложение
- •Термодинамические свойства некоторых веществ
- •Равновесие в системе
- •Алгоритм расчета термодинамических функций физико-химического процесса
Раздел «Электрохимия»
Пример 7
Дана зависимость удельного сопротивления водных растворов HNO2 и СН3СООК от концентрации (табл. 5).
Таблица 5
Концентрация С, кмоль/м3 |
Удельное сопротивление r, Ом · м |
|
HNO2 |
СН3СООК |
|
0,1 |
4,32 |
1,035 |
0,05 |
5,70 |
1,970 |
0,01 |
13,40 |
9,220 |
0,005 |
20,40 |
18,200 |
0,001 |
52,70 |
87,600 |
7.1. Постройте графики удельной æ и молярной l электрических проводимостей растворов HNO2 и СН3СООК от концентрации С.
7.2. Рассчитайте константу диссоциации и проверьте, подчиняются ли растворы HNO2 и СН3СООК в воде закону разведения Оствальда.
7.3. Определите для HNO2 и СН3СООК по данным зависимости молярной электрической проводимости l от концентрации С молярную электрическую проводимость при бесконечном разведении l¥ и сопоставьте экспериментальные величины со справочными, рассчитанными по предельным электрическим проводимостям ионов.
Р е ш е н и е
Для построения графиков необходимо рассчитать по исходным данным (табл. 5) величины удельной электрической проводимости æ и молярной электрической проводимости l по формулам [2, с. 235, 236]:
æ![]() ;
;
![]() .
.
Для измерения æ и l используем единицы СN.
Множитель 1000 при расчете l учитывает перевод концентрации С, в киломолях на кубический метр в С в молях на кубический метр.
Для определения константы диссоциации электролита Кд по закону разведения Оствальда необходимо определить величину степени диссоциации электролита :
![]() ;
;
![]() .
.
Предельную молярную электрическую проводимость l¥ для каждого электролита рассчитаем по справочным значениям предельных молярных электрических проводимостей ионов (приложение, табл. V или [11]).
l¥(HNO2) = l¥(Н+) + l¥(NO2-) = 349,8 · 10-4 + 72,0 · 10-4 = = 421,8 · 10-4 Ом-1 · м2 · моль-1.
l¥(СН3СООК) = l¥(К+) + l¥(СН3СОО-) = 40,09 · 10-4 + 73,5 · 10-4 = = 113,6 · 10-4 Ом-1 · м2 · моль-1.
Приведем расчеты æ, l, a и Кд для HNO2 и СН3СООК для концентрации С = 0,1 кмоль/м3 по данным табл. 5.
HNO2
æ =
![]() = 0,231 Ом-1
· м-1;
l
=
= 0,231 Ом-1
· м-1;
l
=
![]() = 23,2 · 10-4
Ом-1
· м2
· моль-1;
= 23,2 · 10-4
Ом-1
· м2
· моль-1;
![]() ;
;
![]() ;
;
СН3СООК
æ =
![]() = 0,966 Ом-1
· м-1;
l
=
= 0,966 Ом-1
· м-1;
l
=
![]() = 96,6 · 10-4
Ом-1
· м2
· моль-1;
= 96,6 · 10-4
Ом-1
· м2
· моль-1;
![]() ;
;
![]() .
.
Для остальных концентраций (табл. 5) все величины рассчитаем и запишем в табл. 6.
Таблица 6
Вещество |
С, кмоль/м3 |
æ, Ом-1 · м-1 |
l, Ом-1 · м2 · моль-1 |
a |
Кд |
|
0,1 |
0,231 |
23,2 · 10-4 |
0,055 |
3,2 · 10-4 |
HNO2 |
0,05 |
0,175 |
35,0 · 10-4 |
0,083 |
3,76 · 10-4 |
0,01 |
0,0746 |
74,6 · 10-4 |
0,177 |
3,78 · 10-4 |
|
0,005 |
0,0490 |
98,0 · 10-4 |
0,232 |
3,50 · 10-4 |
|
0,001 |
0,0190 |
190 · 10-4 |
0,450 |
3,68 · 10-4 |
|
СН3СООК
|
0,1 |
0,966 |
96,6 · 10-4 |
0,847 |
0,47 |
0,05 |
0,508 |
101,6 · 10-4 |
0,888 |
0,35 |
|
0,01 |
0,108 |
108,0 · 10-4 |
0,944 |
0,16 |
|
0,005 |
0,055 |
110,0 · 10-4 |
0,962 |
0,12 |
|
|
0,001 |
0,011 |
110,0 · 10-4 |
0,962 |
0,12 |
Из графиков æ = f(С) и l = f(С) (рис. 6) следует, что с увеличением концентрации удельная электрическая проводимость æ HNO2 и СН3СООК увеличивается, а молярная электрическая проводимость l уменьшается.
Для HNO2 константы диссоциации практически не изменяются с увеличением концентрации (табл. 6), следовательно, раствор HNO2 подчиняется закону разведения Оствальда, HNO2 является слабым электролитом.
Для СН3СООК константы диссоциации изменяются с изменением концентрации (табл. 6), раствор СН3СООК не подчиняются закону разведения Оствальда, СН3СООК – сильный электролит.
Для определения экспериментальных значений предельных электрических проводимостей l¥(HNO2) и l¥(СН3СООК) проэкстраполируем зависимости l = f(С) (рис. 6) к нулевому значению концентрации:
l¥(HNO2) » 230 · 10-4 Ом-1 · м2 · моль-1;
l¥(СН3СООК) = 112 · 10-4 Ом-4 · м2 · моль-1.
Для HNO2 определенная по графику (рис. 6) величина l¥ плохо согласуется со справочной (421,8 · 10-4 Ом-1 · м2 · моль-1).
Для СН3СООК определенная по графику (рис. 6) величина l¥ хорошо согласуется со справочной (113,6 · 10-4 Ом-4 · м2 · моль-1).
Пример 8
Для окислительно-восстановительного элемента Pt|A,B||C,D|Pt, составленного из электродов Pt|H3AsO4, HAsO2, H+ и Pt|Cr3+, Cr2+ при следующих активностях окисленной и восстановленной форм веществ:
а(H3AsO4) = 0,06; а(HAsO2) = 0,02; а(Cr3+) = 0,025; а(Cr2+) = 0,45.
8.1. Запишите стандартные электродные потенциалы и определите, какой электрод является отрицательным (анодом), а какой – положительным (катодом); напишите схему гальванического окислительно-восстановительного элемента.
8.2. Напишите электронные уравнения процессов, протекающих на каждом электроде, и суммарное уравнение реакции, протекающей в окислительно-восстановительном элементе.
8.3. Вычислите стандартную электродвижущую силу ЭДС элемента и константу химического равновесия.
8.4.
Вычислите ЭДС элемента при Т = 298 К,
соответствующую заданным активностям
окисленной и восстановленной форм
веществ. Примите
![]() =
1;
=
1;
![]() =0,2.
=0,2.
æ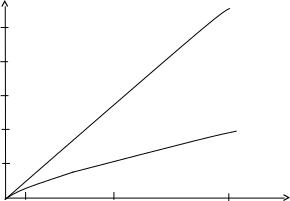 ,
Ом-1·м-1
СН3СООК
,
Ом-1·м-1
СН3СООК
а
1,0
0,8
0,6
0,4
HNO2
0,2
0
0,01 0,05 0,1 С, кмоль/м3
· 104,
О м-1·м2
м-1·м2
· моль-1 200
б
160
120
СН3СООК
80
40
HNO2
0
0,01 0,05 0,1 С, кмоль/м3
Рис. 6. Графики зависимостей удельной (а) и молярной (б) электрических
проводимостей от концентрации для HNO2 и СН3СООК
Р е ш е н и е
8.1. Из справочной табл. VI (приложение или [11, 12]) выпишем значения стандартных электродных потенциалов Е0 для электродов:
Pt|H3AsO4, HAsO2, H+; Е0 = +0,560 В;
Pt|Cr3+, Cr2+; Е0 = –0,408 В.
Отрицательным электродом (анодом) в элементе будет электрод Pt|Cr3+, Cr2+, так как он имеет меньшее значение электродного потенциала, а электрод Pt|H3AsO4, HAsO2, H+ будет катодом.
Составляем схему гальванического окислительно-восстановительного элемента:
А(-)Pt|Cr3+, Cr2+ || H3AsO4, HAsO2, H+|Pt (+)К.
8.2. Запишем электронные уравнения процессов, протекающих на аноде и катоде, и суммарное уравнение реакции в элементе:
-
А(-): Cr2+ – ē = Cr3+
2
окисление
K(+): H3AsO4 + 2H+ + 2ē = HAsO2 + 2H2O
1
восстановление
2Cr2+ + H3AsO4 + 2H+ = 2Cr3+ + HAsO2 + 2H2O.
8.3. Рассчитаем стандартную ЭДС 0 как разность между стандартным электродным потенциалом положительного электрода (катода) и стандартным электродным потенциалом отрицательного электрода (анода) [2, с. 252]:
![]() =
0,560 – (–0,408) = 0,968 В.
=
0,560 – (–0,408) = 0,968 В.
Константу равновесия рассчитаем по формуле, которая вытекает из соотношений: DG0 = –RTlnK [2, с. 112] и DG0 = –nF0 [2, с. 266]:
![]() .
.
n = 2 (число электронов в окислительно-восстановительной реакции элемента); F = 96500 Кл/моль (число Фарадея).
Так как константа равновесия очень велика, реакция в элементе практически необратима и протекает в прямом направлении.
8.4. Рассчитаем равновесные электродные потенциалы, соответствующие заданным активностям, по уравнению Нернста [2, с. 258] при Т = 298 К:
![]() ,
,
где n – число электронов в электродной реакции;
Па0, ПаR – произведение активностей окисленной и восстановленной форм веществ, соответственно.
![]()
=
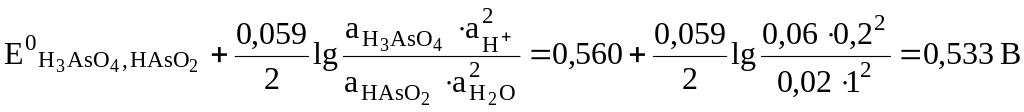 ;
;
![]() =
=![]() .
.
Рассчитаем ЭДС элемента, соответствующую рассчитанным значениям равновесных потенциалов электродов:
= 0,533 – (–0,482) = 1,015 В.
Пример 9
Для элемента,
составленного из водородного электрода
Н+|H2,Pt
(пластина насыщена водородом при давлении
![]() =
2,0 атм) в растворе электролита С:
=
2,0 атм) в растворе электролита С:
Вариант 1. НСООН с концентрацией Сm = 0,1 моль/кг Н2О;
Вариант 2. NaOH с концентрацией Сm = 0,1моль/кг Н2О,
и каломельного электрода Hg, Hg2Cl2|Cl- с концентрацией KCl Сm = = 0,5 моль/кг Н2О.
9.1. Вычислите электродные потенциалы водородного и каломельного электродов.
9.2. Вычислите ЭДС элемента (диффузионную ЭДС примите равной нулю).
9.3. Вычислите рН раствора электролита С.
Р е ш е н и е
9.1. Рассчитаем потенциал каломельного электрода по уравнению Нернста [2, с. 259], приняв моляльную концентрацию KCl равной молярной, активности твердых фаз Hg и Hg2Cl2 равными единице, коэффициент активности KCl равным единице.
Электродная реакция, протекающая на каломельном электроде, и соответствующая величина стандартного электродного потенциала (приложение, табл. VI или [11, 12]):
½ Hg2Cl2
+ ē = Hg
+ Cl-
;
![]() .
.
Каломельный электрод относится к электродам второго рода, тогда, в соответствии с уравнением Нернста (Т = 298 К):
![]() =
=
![]() ,
,
где
![]() ;
;
n = 1 (число электронов в электродной реакции).
![]() .
.
Рассчитаем потенциал водородного электрода (Т = 298 К), который относится к газовым электродам, также по уравнению Нернста [2, с. 258].
Из табл. VI (приложение) или [11, 12] запишем электродную реакцию, протекающую на водородном электроде, и величину стандартного электродного потенциала.
Н+
+ ē = ½ Н2;
![]() = 0;
= 0;
![]() =
=
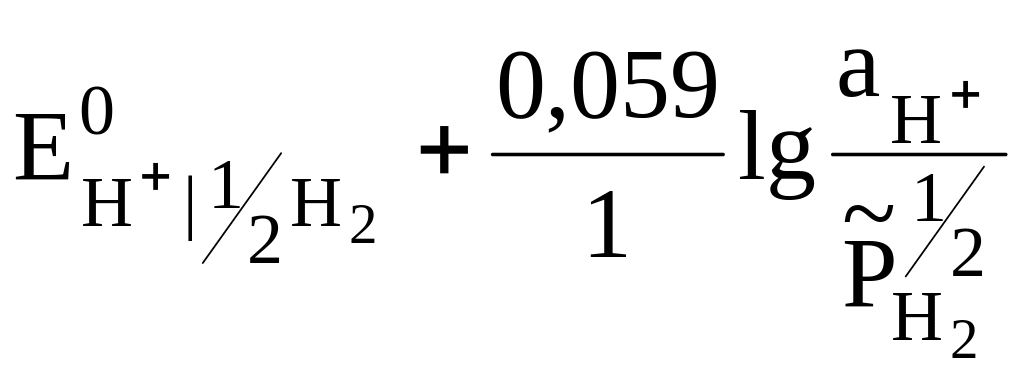 ,
,
где
![]()
активность катионов водорода;
активность катионов водорода;
![]() относительное
парциальное давление водорода;
относительное
парциальное давление водорода;
Если давление выражается в атмосферах, то:
![]() .
.
Вариант 1
Электролит С – НСООН (слабая кислота), Сm = 0,1 моль/кг Н2О; Кд = 1,772 · 10-4 (прил., табл. VII или [9,10]).
В этом случае
![]()
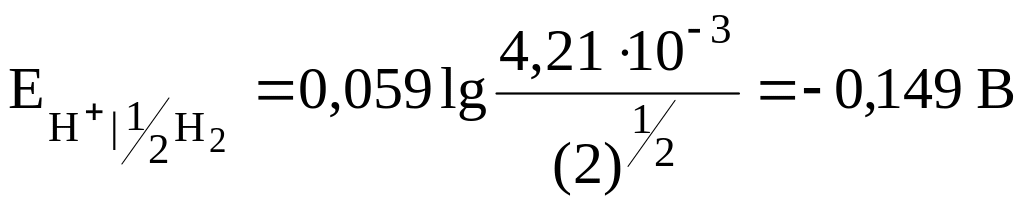 .
.
Вариант 2
Электролит С – NaOH (сильный электролит), Сm = 0,1 моль/кг Н2О.
Примем Сm(NaOH) = См(NaOH); (NaOH) = 1;
тогда
![]() =
а(NaOH)
= См(NaOH)
· (NaOH)
= 0,1 · 1 = 0,1.
=
а(NaOH)
= См(NaOH)
· (NaOH)
= 0,1 · 1 = 0,1.
Учитывая, что ионное произведение воды при 298К равно 1 · 10-14:
![]() ;
;
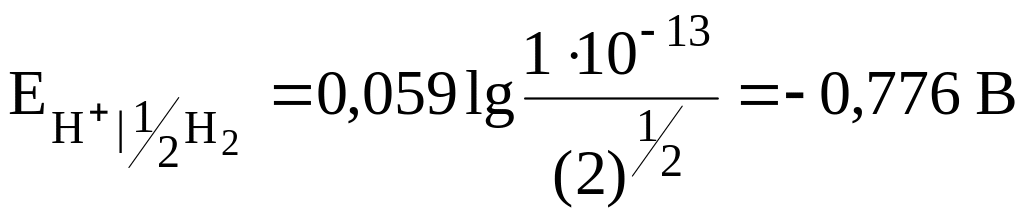 .
.
9.2. Вычислим ЭДС элемента, составленного из водородного и каломельного электродов:
А(-) Pt,H2|H+ || Cl-|Hg2Cl2, Hg (+)K,
в котором анодом (отрицательным) электродом является водородный электрод, так как меньшее значение электродного потенциала
![]()
![]() ;
;
Вариант 1
= 0,285 – (-0,149) = 0,434 В;
Вариант 2
= 0,285 – (-0,776) = 1,061 В.
9.3. Вычислим рН раствора электролита С
Вариант 1
Электролит НСООН, Сm = 0,1 моль/кг Н2О
рН = -lg![]() = -lg4,21
· 10-3
= 2,38;
= -lg4,21
· 10-3
= 2,38;
рН < 7, среда кислая;
Вариант 2
Электролит NaOH, Сm = 0,1 моль/кг Н2О
рН = -lg1 · 10-13 = 13;
рН > 7, среда щелочная.
Пример 10
Для реакции
2Ag + Hg2Cl2 = 2AgCl + 2Hg,
протекающей обратимо в гальваническом элементе, дано уравнение зависимости ЭДС от температуры:
= 0,556 + 3,388 · 10-4Т.
10.1. При температуре Т = 323 К вычислите ЭДС элемента и термодинамические параметры (G, H, S) реакции, протекающей в элементе.
10.2. По полученным значениям термодинамических функций охарактеризуйте реакцию, протекающую в элементе.
Р е ш е н и е
Для реакции 2Ag + Hg2Cl2 = 2AgCl + 2Hg число электронов, принимающих участие в токообразующей реакции, n = 2.
А(-): 2Ag – 2ē + 2Cl- = 2AgCl
K(+): Hg2Cl2 + 2ē = 2Hg + 2Cl-.
10.1. Рассчитаем ЭДС при 323 К по заданному уравнению:
= 0,556 + 3,388 · 10-4 · 323 = 0,665 В.
Изменение энергии Гиббса равно [2, с. 266]:
G = –nF,
где n – число электронов в токообразующей реакции;
F – число Фарадея (96500 Кл/моль).
G = –2 · 96500 · 0,665 = –128345 Дж = 128,3 кДж.
Изменение энтропии можно рассчитать, зная зависимость ЭДС от температуры [2, с. 266]:
![]() ,
,
где
![]() – температурный коэффициент ЭДС.
– температурный коэффициент ЭДС.
Для определения температурного коэффициента ЭДС продифференцируем по температуре уравнение зависимости от Т
![]() .
.
Тогда S = 2 · 96500 · 3,388 · 10-4 = 65,39 Дж/К.
Изменение энтальпии можно выразить из известного соотношения:
G = H - TS, откуда
![]() =
=
= –2 · 96500 (0,665 – 323 · 3,388 · 10-4) = –107224,5 Дж = –107,2 кДж.
10.2. Охарактеризуем реакцию, протекающую в элементе:
G < 0, следовательно, при постоянных давлении и температуре реакция протекает самопроизвольно;
S > 0, реакция протекает с увеличением беспорядка в системе (система становится менее упорядоченной);
Н < 0, реакция протекает с выделением теплоты, т. е. является экзотермической.
