
- •Введение
- •Предмет молекулярной физики
- •2. Массы атомов и молекул. Количество вещества
- •Примеры
- •Молекулярные силы
- •4. Агрегатные состояния вещества. Особенности теплового движения в различных агрегатных состояниях вещества
- •Глава 1. Основы кинетической теории идеального газа
- •Модель идеального газа
- •1.2. Равновесные состояния и процессы
- •1.3. Распределение молекул газа, находящегося в состоянии равновесия, по направлениям движения
- •Примеры
- •1.4. Число ударов молекул о стенку сосуда
- •1.5. Основное уравнение кинетической теории газов для давления
- •1.6 Температура и её измерение. Опытные температурные шкалы.
- •1.7 Идеально-газовая шкала температур.
- •2. Измерение давления газа при постоянном объёме производится с большей точностью, чем измерение объёма при постоянном давлении.
- •Температура - мера средней кинетической энергии поступательного движения молекул.
- •1.9 Уравнение Менделеева-Клапейрона. Следствия из этого уравнения.
- •Примеры
1.3. Распределение молекул газа, находящегося в состоянии равновесия, по направлениям движения
Рассмотрим газ находящийся в состоянии равновесия. При этом он занимает объем V и содержит N молекул. При отсутствии внешних сил молекулы газа распределяются равномерно по объему V и движутся хаотически не имея преимущественного направления. Если провести сферу радиуса R вокруг объема V и в произвольный момент времени продолжить направления скоростей движения всех молекул до пересечения с этой сферой, то вся сфера покроется точками в местах этих пересечений. Причем из-за отсутствия преимущественного направления в движении молекул (равновесие) поверхностная плотность этих точек = N /4R2 будет постоянна по всей сфере в любой момент времени.
Выберем на сфере произвольную элементарную площадку dS Тогда количество точек, оказавшихся на этой площадке
dN = NdS /4R2= Nd /4 (1.3.1)
где d = dS /R2 - телесный угол, под которым видна площадка из
центра сферы. (Полный телесный угол, стягиваемый сферой = ∫ d = ∫ dS/R2 =4R2/R2=4)
Соотношение (1.3.1) можно представить в виде:
dN / N = d /4 (1.3.2)
Левая часть равенства (1.3.2) представляет собой отношение числа молекул dN, направления скоростей которых заключены и телесном угле d, к общему числу молекул и при большом N равна вероятности того, что "взятая наугад" молекула в газе имеет направление скорости, заключенное в телесном угле d Формула (1.3.2) выражает закон равновероятности направлений движения молекул в равновесном состоянии газа.*
* Основные сведения из теории вероятностей даны в Приложении А. Нумерация формул в Приложении А дается по форме (А.5), что означает: формула 5 Приложения А.
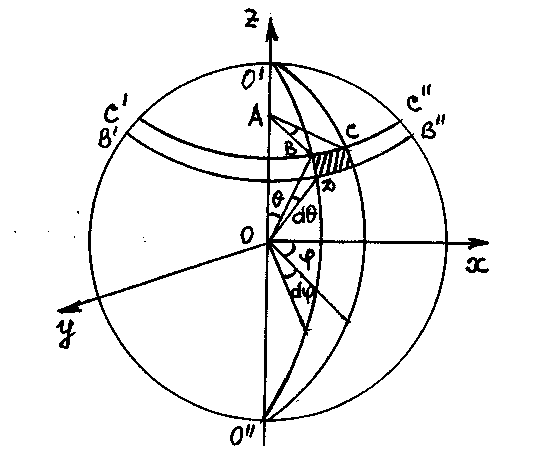
Р и с. 7
Найдем дифференциал площади dS в сферической системе координат. Для этого проведем через ось Z (рис. 7) две бесконечно близкие плоскости под углами и + d к плоскости XOZ. Они пересекут сферу по окружностям O΄BO΄΄ и O΄CO΄΄ радиуса R. Далее проведем два конуса с углами 2 и 2(+d) при вершине O , которые пересекут сферу по окружностям С΄СС΄΄и В΄DВ΄΄. В результате пересечения четырех указанных окружностей получается элемент сферы, (на рис.7 заштрихован) площадь которого
dS =BC·BD, (1.3.3)
где BC = ABd=R sin d , BD =R d
Подставляя последние величины в формулу (1.3.3), получим выражение для бесконечно малой площади в сферической системе координат:
dS=R 2sin d d (1.3.4)
Из выражений (1.3.4) и (1.3.1) находим число частиц, которые имеют направления, определяемые сферическими углами, лежащими в интервалах от до + d и от до + d :
dN,=N sin d d /4 (1.3.5)
Если разделить обе части соотношения (1.3.5) на объем V, занимаемый газом, то получим
dn,=n sin d d /4 (1.3.6)
где dn,=dN, /N - число молекул в единице объема, которые имеют направления вектора скорости близкое к направлению, определяемому углами и , n=N/V - число молекул в единице объема с любыми направлениями движения.
