
- •А.В. Юрьева аналитическая химия Учебное пособие
- •Предисловие
- •Глава 1. Аналитическая химия как наука
- •1.1. Предмет и методы аналитической химии. Качественный и количественный анализ
- •1.2. Значение аналитической химии
- •1.3. Краткий очерк развития аналитической химии
- •Глава 2. Качественный химический анализ
- •2.1. Особенности аналитических реакций и способы их выполнения
- •2.2. Требования к аналитическим реакциям. Чувствительность реакций. Селективные и специфические реакции
- •2.3. Дробный и систематический анализ
- •2.4. Классификации катионов
- •Сульфидная классификация катионов
- •Деление катионов на группы по кислотно-основной классификации
- •2.5. Классификация анионов
- •Классификация анионов
- •2.6. Анализ конкретных объектов
- •Изменения проб при нагревании на пластинке
- •2.7 Основы качественного анализа органических соединений
- •Практические работы
- •Групы по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов третьей аналитической группы по кислотно-основной классификации
- •Растворимость в воде некоторых солей катионов I–III аналитических групп по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов четвертой аналитической группы по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов пятой аналитической группы по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов шестой аналитической группы по кислотно-основной классификации
- •Вопросы и задачи
- •Глава 3. Метрологические основы химического анализа
- •3.1. Общая схема аналитического определения
- •Выбор метода анализа
- •Отбор и подготовка пробы к анализу
- •Проведение измерения
- •Расчет результатов анализа
- •Погрешности химического анализа
- •3.2.1. Систематические погрешности
- •3.2.2. Случайные погрешности
- •Значение t для различной доверительной вероятности
- •Вопросы и задачи
- •Глава 4. Количественный анализ. Химические методы
- •4.1. Гравиметрический анализ
- •4.1.1. Осаждение
- •4.1.2. Фильтрование и промывание осадка
- •4.1.3.Высушивание и прокаливание
- •4.1.4. Вычисления в гравиметрическом анализе
- •Практические работы
- •Вопросы и задачи
- •Глава 5. Титриметрический анализ
- •5.1. Сущность титриметрического анализа
- •5.2. Стандартизация раствора титранта
- •5.3. Основные приемы титриметрических определений
- •5.4. Расчеты в титриметрическом анализе
- •5.5. Кривые титрования
- •5.6. Основные методы титриметрического анализа
- •5.7. Техника работы
- •Вопросы и задачи
- •Глава 6. Реакции кислотно-основного взаимодействия
- •6.1. Протолитическая теория кислот и оснований Бренстеда-Лоури
- •6.2. Электронная теория Льюиса
- •6.3. Кислотно-основные и некоторые другие свойства растворителей
- •6.4. Равновесия в водных растворах кислот и оснований
- •6.5. Буферные растворы
- •6.6. Кислотно-основные индикаторы
- •Вопросы и задачи
- •Глава 7. Кислотно-основное титрование
- •7.1. Рабочие растворы
- •7.2. Кривые титрования и выбор индикатора
- •7.3. Практическое применение методов кислотно-основного титрования
- •Практические работы
- •Вопросы и задачи
- •Глава 8. Реакции окисления-восстановления. Окислительно-восстановительное титрование
- •Окислительно-восстановительное титрование
- •8.1. Требованиям к реакциям в методе окислительно-восстановительного титрования
- •8.2. Способы установления точки эквивалентности
- •8.3. Молярная масса эквивалента в реакциях окисления-восстановления
- •8.4. Кривые титрования
- •8.5. Индикаторы
- •8.6. Классификация методов окислительно-восстановительного титрования
- •8.7. Перманганатометрия
- •Практические работы
- •8.8. Иодометрия
- •Практические работы
- •8.9. Хроматометрия
- •Вопросы и задачи
- •Глава 9. Титрование по методу осаждения
- •9.1. Аргентометрия
- •9.2. Меркурометрия
- •Практические работы
- •Вопросы и задачи
- •Глава 10. Комплексометрическое титрование
- •10.1. Комплексонометрия
- •10.1.1. Рабочие растворы
- •10.1.2. Кривые титрования
- •10.1.3. Способы обнаружения конечной точки титрования
- •10.1.4. Применение комплексонометрии
- •Практические работы
- •Вопросы и задачи
- •Глава 11. Методы маскирования, разделения и концентрирования
- •11.1. Маскирование
- •11.2. Разделение и концентрирование
- •11.3. Краткая характеристика некоторых методов разделения и концентрирования
- •Вопросы и задачи
- •Глава 12. Биологические методы анализа
- •Вопросы
- •Библиографический список
- •Оглавление
- •Глава 1. Аналитическая химия как наука………………………….. ………… 4
- •Глава 2. Качественный химический анализ…………………………………….. 8
- •Глава 3. Метрологические основы химического анализа……………………. 50
- •Глава 4. Количественный анализ. Химические методы………………………. 63
- •Глава 5. Титриметрический анализ………………………………………………. 77
- •Глава 6. Реакции кислотно-основного взаимодействия ……………………… 89
- •Глава 7. Кислотно-основное титрование………………………………………… 100
- •Глава 8. Реакции окисления-восстановления. Окислительно-
Окислительно-восстановительное титрование
В основе этого метода лежит изменение потенциала окислительно-восстановительной системы при изменении соотношения концентраций окисленной и восстановленной форм в процессе титрования.
8.1. Требованиям к реакциям в методе окислительно-восстановительного титрования
Первым
требованием является полнота протекания
реакции, это возможно, если константа
равновесия K>108,
т.е.
 ,
а отсюда следует, что в качестве рабочих
растворов могут быть использованы
только сильные окислители или сильные
восстановители.
,
а отсюда следует, что в качестве рабочих
растворов могут быть использованы
только сильные окислители или сильные
восстановители.
Второе требование: скорость реакции должна быть велика и не должны протекать побочные реакции. Для увеличения скорости повышают температуру, изменяют pH или концентрацию реагирующих веществ, используют катализаторы.
И, наконец, обязательное требование: должна быть возможность фиксации точки эквивалентности.
8.2. Способы установления точки эквивалентности
В методе окислительно-восстановительного титрования точку эквивалентности (конечную точку титрования) можно фиксировать:
1) по окраске избытка прибавленного рабочего раствора (безиндикаторный способ);
2) введением в раствор веществ, специфически реагирующих с веществом рабочего раствора или с определенным веществом с образованием окрашенных соединений;
3) посредством окислительно-восстановительных индикаторов, изменяющих окраску в зависимости от изменения окислительно-восстановительного потенциала системы;
4) инструментальными методами.
8.3. Молярная масса эквивалента в реакциях окисления-восстановления
Молярная масса эквивалента окислителя или восстановителя зависит от числа принимающих или отдаваемых электронов в данной реакции и численно равна отношению молярной массы вещества M(Х) к числу принятых или отданных электронов (n):
![]() .
.
Так, в кислой среде
![]() восстанавливается до Mn2+
:
восстанавливается до Mn2+
:
![]() ,
поэтому молярная масса эквивалента
KMnO4
в этой реакции
,
поэтому молярная масса эквивалента
KMnO4
в этой реакции
![]()
В слабо-кислой, нейтральной и щелочной средах восстановление происходит до MnO2:
![]() и в этом случае
и в этом случае
![]()
8.4. Кривые титрования
В рассматриваемом методе кривые титрования строят в координатах «потенциал окислительно-восстановительной системы – объем добавленного рабочего раствора (или степень оттитрованности)»
Рассчитаем кривую
титрования 100,0 мл 0,1 н. FeSO4
раствором 0,1 н. KMnO4 (fэкв
= 1/5) в кислой среде при [H+]
= 1,0 в соответствии с уравнением реакции
![]() .
.
После добавления первых капель перманганата калия в растворе образуется две окислительно-восстановительные пары: /Mn2+ и Fe3+/Fe2+, потенциал каждой из которых можно вычислить по уравнению Нериста:
 ;
;
![]() .
.
До точки эквивалентности потенциал целесообразно рассчитывать по второму из этих уравнений, а после точки эквивалентности – по первому. Количество вещества Fe3+ до точки эквивалентности будет равно количеству вещества эквивалентов добавленного KMnO4.
Если к 100,0 мл FeSO4
добавить 1,0 мл 0,1н. KMnO4
(fэкв
= 1/5), то в результате реакции образуется
эквивалентное количество вещества
Fe3+,
концентрация которого в растворе будет
равна
![]() моль/л, а концентрация ионов Fe2+
составит 0,099 моль/л. Тогда
окислительно-восстановительный потенциал
раствора:
моль/л, а концентрация ионов Fe2+
составит 0,099 моль/л. Тогда
окислительно-восстановительный потенциал
раствора:
![]() .
Остальная часть кривой титрования до
точки эквивалентности рассчитывается
аналогично.
.
Остальная часть кривой титрования до
точки эквивалентности рассчитывается
аналогично.
В точке эквивалентности концентрация вещества рассчитывается с помощью константы равновесия
 .
.
Обозначим равновесную
концентрацию
в
точке эквивалентности как x,
тогда [Fe2+]
= 5x
и концентрация остальных ионов составляет:
[Fe3+]
= 0,1-5x
= = 5(0,02-x)
и [Mn2+]
= 0,02 – x,
примем также, что [H+]
= 1. Значение константы равновесия можно
найти из величин стандартных потенциалов
из уравнения
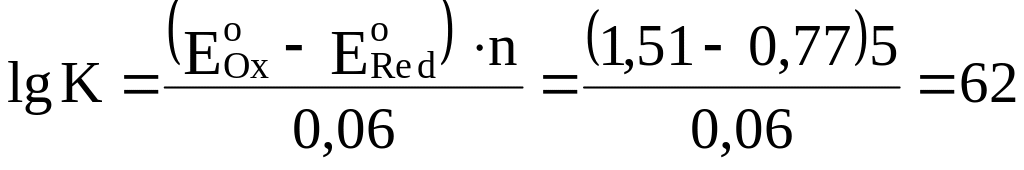 и K
= 1062.
и K
= 1062.
При расчете получаем
![]() ,
,
следовательно,
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Тогда
![]()
![]() В,
В,
а
![]() В.
Небольшое расхождение в величине E
вполне объяснимо округлением при расчете
равновесных концентраций.
В.
Небольшое расхождение в величине E
вполне объяснимо округлением при расчете
равновесных концентраций.
После точки
эквивалентности избыток KMnO4
в 0,1 мл при разбавлении до 100,0
мл создает в растворе концентрацию
перманганата
![]() ,
а концентрация [Mn2+]
= 0,02 моль/л останется практически без
изменений такой же, какой она была в
точке эквивалентности. Подстановка
этих значений в уравнение для потенциала
дает
,
а концентрация [Mn2+]
= 0,02 моль/л останется практически без
изменений такой же, какой она была в
точке эквивалентности. Подстановка
этих значений в уравнение для потенциала
дает
![]() В,
если перетитровать на 1мл, то потенциал
будет равен 1,49 В и.т.д. Кривая титрования
Fe2+
перманганатом калия представлена на
рис. 8.1.
В,
если перетитровать на 1мл, то потенциал
будет равен 1,49 В и.т.д. Кривая титрования
Fe2+
перманганатом калия представлена на
рис. 8.1.
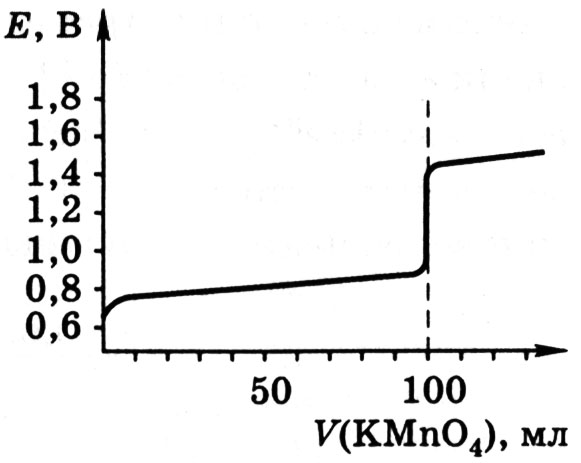
Рис. 8.1. Кривая титрования 100,0 мл 0,1 н. FeSO4 0,1 н. раствором KMnO4
(fэкв = 1/5) при [H+] = 1,0
В области точки эквивалентности при переходе от раствора, недотитрованного на 0,1 %, потенциал изменяется больше, чем на 0,5 В. Резкий скачок потенциала позволяет использовать для обнаружения точки эквивалентности непосредственно потенциометрические измерения или окислительно-восстановительные (редокс) индикаторы, окраска которых изменяется при изменении потенциала.
