
- •Загальна характеристика неметалів. Положення в пс. Будова атомів неметалів.
- •Загальна характеристика галогенів. Валентність та ступінь окиснення атомів.
- •Поширення в природі.
- •Фізичні,хімічні властивості олово, плюмбума.
- •Загальна характеристика елементів 6 групи головної підгрупи. Їх розташування в пс та будова атомів.Валентність,ступені окислення. Змінення властивостей по группі.
- •Алотропні модифікації Сульфуру. Характеристика фізичних та хімічних властивостей Сульфуру. Використання сульфуру.
- •Ферум в природі,добування,використання.Властивості Феруму. Сполуки. Якісні реакції.
- •Сірководень, його одержання,використання. Фіз. І хім..Властивості.
- •Оксиди сульфуру(4 і 6 валентного)Одержання і використання. Фізичні та хімічні властивості.
- •Сульфітна кислота.Сульфіти. Одержання.Властивості.Використання.
- •Сульфана кислота.Одержання.Використання
- •Сульфати.Одержання,використання, властивості.
- •Амоніак, його добування, властивості.
- •Нітроген в природі, фізичні хімічні властивості, сполуки.
- •Сполуки азоту
- •Нітратна кислота
- •Властивості кальцію і магнію
Ферум в природі,добування,використання.Властивості Феруму. Сполуки. Якісні реакції.
У природі зустрічається у вигляді сполук. Найпоширеніші: Оксиди: FeO(Ферум два оксид),Fe2O3(Ферум три оскид). Сполуки трьохвалентного феруму мають забарвлення від жовтого до бурого, залежно від складу. Ферум входить до складу багатьох різних мінералів у вигляді оксидів, сульфідів та сполук з іншими елементами. Скупчення є джерелом залізної руди, з якої потім видобувають залізо. Сполуки феруму розчинені у деяких видах водних джерел, і надає смак металу. Атоми феруму входять до складу організму. У вигляді простої речовини зустрічаються в залишках метеориту.
Застосовують здебільш у сплавах чавуну і сталі. Раніше з чавуну виробляли гармати, а зараз верстата(там де бажана міцність, а не пластичність).широко застосовують в іржостійкій сталі.
Характерний ступінь окиснення +2,+3. Проявляє металічні властивості.
Фіз.властивості форуму: Залізо речовина з не молекулярною будовою. У звичайних умовах метал сірого кольору з металічним блиском, добре проводить електричний струм і темплоту. Залізо пластичний метал і піддається куванню. Температура плавління +1540. Залізо не розчиняється у воді чи інших розчинниках, але розчиняється в ртуті. Притягується магнітом.
Хімічні властивості – досить активно вступає в хім..взаємодії. Переважно вступає з неметалами. Активно взаємодіє з киснем:
3Fe+2О2= Fe3О4
Також активно взаємодіє з хлором.
2Fe+3СІ2= 2FeCl3
Активно взаємодіє з сіркою:
Fe +S = FeS
3Fe+4H2O=Fe3O4+4H2
Cполуки:
Сірководень, його одержання,використання. Фіз. І хім..Властивості.
Сірководень отримують шляхо викокої температури і взаємодії сірки з гідрогеном. При цього вічуваємо запах тухлих яєць. Дуже отруйний. Розчиняється у воді. Проявляє себе як сильний відновник і слабка кислота.
Одержання
Хоч сірководень і утворюється при взаємодії водню із сіркою при нагріванні, але його зручніше добувати при дії хлоридної кислоти на сульфід заліза:
![]()
Хімічні властивості
Хімічний зв'язок сірки з воднем у молекулі сірководню ковалентний. Спільні електронні пари зміщені від атомів водню до атомів сірки, тому сірка виявляє негативну валентність. У водному розчині це зміщення є ще більшим. У хімічному відношенні сірководень — сильний відновник. Відновні властивості його обумовлюються тим, що іон сірки S2- порівняно легко втрачає два електрони і перетворюється в нейтральний атом сірки S0, а під впливом сильних окисників втрачає шість електронів і перетворюється в позитивно заряджені іони S4+. Так, при достатньому доступі кисню сірководень горить на повітрі з утворенням двоокису сірки і водяної пари:
![]()
Оксиди сульфуру(4 і 6 валентного)Одержання і використання. Фізичні та хімічні властивості.
Сульфур(IV) оксид
Ступінь окиснення Сульфуру +4: S+4O2-2
Фізичні властивості.
Сульфур(IV) оксид, сульфур діоксид, - безбарвний газ із різким запахом, що викликає кашель, у 2,2 рази важчий за повітря, дуже легко розчиняється у воді (в 1 л води при 20OC - 49 л оксиду).
Хімічні властивості.
Поряд з „фізичним” розчиненням одночасно відбувається хімічна взаємодія – приєднання молекул води (гідратація), внаслідок чого утворюється сульфітна кислота.
Сульфур(IV) оксид - кислотний оксид. Він взаємодіє з основними оксидами і лугами:
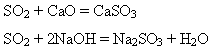
За наявності сильних відновників виявляє властивості окисника:
![]()
Сульфур(IV) оксид вбиває мікроорганізми, з органічними фарбами утворює безбарвні сполуки.
Добування У лабораторних умовах:
дією хлоридної або сульфатної кислоти на сульфіти:
![]()
Сульфур(VI) оксид
Молекулярна формула – SO3.
Фізичні властивості.
Сульфур(VI) оксид, або сульфур триоксид, - безбарвна рідина з температурою кипіння 45OC. За температури, нижчої від 17OC, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже летка речовина, токсична, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки, руйнує органічні сполуки. Зберігають у запаяних скляних посудинах (ампулах).
Хімічні властивості.
Сульфур(VI) оксид – на повітря димить, вбираючи вологу з повітря, бурхливо взаємодіє з водою:
SO3 + H2O = H2SO4
Виявляє сильні окисні властивості, відновлюючись зазвичай до сульфур(IV) оксиду:
![]()
Використовують для добування сульфатної кислоти.
