- •17. Карбоновые кислоты, номенклатура и способы получения, отличия в физических св-ах.
- •18. Химические св-ва карбоновых кислот.
- •19. Нитросоединения. Электронное строение, понятие о семиполярных связях. Способы получения.
- •20. Химические св-ва нитросоединений, понятие о псевдокислотах Ганча.
- •21. Алифатические амины. Классификация, способы получения и химические св-ва.
- •22. Замещённые карбоновые кислоты, особенности физических и химических свойств, способы получения галогено-, окси-, аминокислот.
- •23. Оптическая изомерия , связь оптической активности со строением органических веществ.
- •24. Алициклические углеводороды (циклоалканы): классификация, номенклатура, строение, способы получения, изомерия циклопарафинов.
- •25. Химические свойства циклопарафинов в зависимости от размера цикла
- •26. Отличие химических свойств циклопентадиена. Понятие о ферроценах. Классификация ароматических соединений.
- •27. Ароматические углеводороды. Номенклатура, способы получения.
- •28. Химические свойства ароматических углеводородов. Механизм реакции электрофильного замещения в ароматическом ядре.
- •29. Правила электрофильного замещения в ароматическом ядре. Заместители первого и второго рода.
- •30. Галогенпроизводные ароматических углеводородов.
- •31. Нитропроизводные ароматических углеводородов.
- •32. Арилсульфокислоты.
- •33. Ариламины.
21. Алифатические амины. Классификация, способы получения и химические св-ва.
Алифатические амины образуются, когда один или большее количество атомов водорода в аммиаке () заменяются одним, двумя или тремя алкильными или алкоксильными радикалами. Низшие алифатические амины представляют собой газы, подобно аммиаку, и легко растворимы в воде, тогда как высшие гомологи нерастворимы в воде. Все алифатические амины являются основаниями в растворах и образуют соли. Соли представляют собой нелетучие твердые вещества без запаха, легко растворимые в воде.
Ароматические амины могут быть первичными ArNH2 (анилин, толуидины), вторичными Ar2NH (дифениламин), и третичными Ar3N (трифениламин).
Ароматические амины получают из арилгалогенидов и аммиака: ArCl + 2 NH3 Ar-NH2 + NH4Cl
Ароматические амины могут также быть получены из кислот через амиды по реакции Гофмана.
Ароматические вторичные амины получают нагреванием ароматических аминов с их солями: Ar-NH2 + Ar-NH2HCl Ar2NH + NH4Cl
Вторичные жирноароматические амины получают алкилированием первичных ароматических аминов галогенпроизводными или спиртами.
Третичные ароматические амины получают алкилированием или арилированием первичных или вторичных аминов:C6H5-NH2 + 2 CH3OH C6H5-N(CH3)2 + 2 H2O
Химические св-ва:
1. Алкилирование ароматических аминов.
Ароматические амины способны замещать водород аминогруппы на алкилы. Эта реакция приводит ко вторичным и третичным аминам: C6H5NH2 + CH3J C6H5NH-CH3 + CH3J C6H5N-(CH3)2
2. Ацилирование ароматических аминов.
При действии ацилирующих агентов (кислоты, ангидриды, хлорангидриды) водородные атомы аминогруппы замещаются на ацильные остатки. C6H5NH2 + (CH3CO)2O C6H5NHCO-CH3 + CH3COOH
3. Синтез азометинов (оснований Шиффа).
При слабом нагревании ароматических первичных аминов с ароматическими альдегидами легко образуются так называемые основания Шиффа или азометины: C6H5NH2 + C6H5COH C6H5N=CH-C6H5 + H2O
4. Реакции аминов с азотистой кислотой.
Азотистая кислота HONO неустойчива, но ее водный раствор можно получить, растворив нитрит натрия, при охлаждении в разбавленной кислоте, например, соляной.
22. Замещённые карбоновые кислоты, особенности физических и химических свойств, способы получения галогено-, окси-, аминокислот.
Аминокислоты NH2–R–COOH. Гидроксикислоты HO–R–COOH.
Гидроксикислоты проявляют двойственные свойства карбоновых кислот и спиртов. Аминокислоты проявл двойственные свойства карбоновых кислот и аминов.
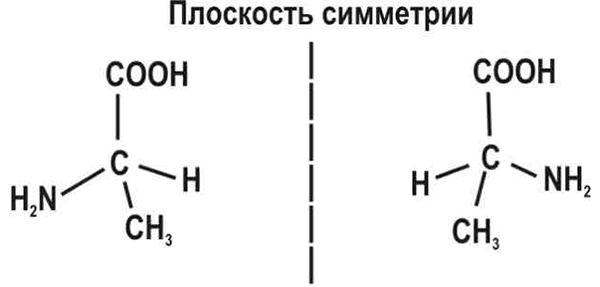
23. Оптическая изомерия , связь оптической активности со строением органических веществ.
Опти́ческая изомери́я — разновидность пространственной изомерии. Проявляется способностью некоторых веществ поворачивать плоскость поляризованного луча в противоположные стороны. Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии, которые относятся друг к другу как предмет к своему зеркальному отражению. Оптические изомеры имеют одинаковые физические и химические свойства, но различаются отношением к поляризованному свету. Такие изомеры обладают оптической активностью (один из них вращает плоскость поляризованного света влево, а другой - на такой же угол вправо). Различия в химических свойствах наблюдаются только в реакциях с оптически активными реагентами.
Причиной оптической активности является асимметрия молекулы, обусловленная неидентичностью четырех атомов или групп вокруг одного из атомов углерода в оптически активной молекуле.
аланин
CH3CHNH2COOH (рис. 1). Наличие у такой молекулы
двух разных конфигураций связано с тем,
что у атома углерода, образующего четыре
одинарные связи, эти связи направлены
к вершинам тетраэдра.