
- •1. Одноэлектронное приближение. Электронная конфигурация атома. Принципы заполнения одноэлектронных состояний.
- •2. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •3. Гетерогенный катализ: основные стадии, энергетический профиль.
- •4. Расчёт электродных потенциалов по уравнению Нернста.
- •1. Электронное состояние атома как целого. Квантовые числа. Атомные
- •2. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определения энтропии, их взаимосвязь.
- •3. Фотохимические реакции. Законы фотохимии. Квантовый выход. Примеры фотохимических реакций.
- •4. Анализ конкретной фазовой диаграммы двухкомпонентной системы.
- •Водородоподобные атомы. Уровни энергии и квантовые числа электрона.
- •2. Исходные постулаты термодинамики. Термические и калорические уравнения состояния.
- •3. Квазистационарное приближение в химической кинетике. Условия применимости, энергетические кривые.
- •4. Равновесный состав газовой смеси.
- •1. Электронные конфигурации переходных элементов 4-го периода и их ионов.
- •2. Коллигативные свойства растворов (электролиты и неэлектролиты).
- •3. Скорость химической реакции. Кинетическое уравнение. Закон действующих масс для элементарных реакций.
- •4. Энергии Гиббса химической реакции при различных температурах.
- •1. Электронные состояния двухатомных молекул. Характеристики кова-
- •2. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье.
- •3. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости.
- •1. Химическая связь и причины её образования. Кривые потенциальной энергии для двухатомной молекулы.
- •2. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •3. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •4. Порядок реакции по кинетическим данным.
- •1. Простейшие понятия теории молекулярных орбиталей. Метод молкао.
- •2. Электродвижущая сила (эдс), ее связь с термодинамическими функциями. Типы электрохимических ячеек.
- •3. Формальная кинетика реакций 1-го порядка. Решение прямой и обратной задачи.
- •4. Изменение энтропии в различных процессах (изменение температуры, объема, давления, фазовый переход, химическая реакция).
- •Теория мо. Электронные конфигурации молекул и молекулярных ионов водорода и гелия.
- •2. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •3. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •4. Константы скорости в параллельных реакциях.
- •1. Межмолекулярные взаимодействия и их классификация. Сравнение межмолекулярных
- •2. Третий закон термодинамики. Абсолютная энтропия.
- •3. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •4. Константа химического равновесия и равновесного состава смеси веществ.
- •Водородная связь и её характеристики. Примеры неорганических веществ с водородной связью.
- •2. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •3. Механизмы реакций. Решение кинетических уравнений для последовательных реакций первого порядка.
- •4. Фазовые диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •2. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Принцип независимости химических реакций. Составление и решение кинетических уравнений для обратимых реакций первого порядка.
- •4. Давления пара над чистым веществом и теплота фазового перехода.
- •1. Водородная связь и её характеристики. Влияние водородной связи на свойства органических веществ.
- •2. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •3. Механизм реакции. Составление и решение кинетических уравнений для параллельных реакций первого порядка.
- •4. Эмпирическая константа скорости и эффективная энергия активации сложной реакции.
- •1. Полиморфизм металлов (на примере железа или олова).
- •2. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •3. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •4. Состав пара над идеальным раствором.
- •1. Основные типы кристаллических решёток металлов. Плотнейшие шаровые упаковки.
- •2. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •3. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •4. Квантовый выход фотохимической реакции.
- •1. Структура ионных кристаллов. Ионная модель.
- •2. Объединение 1-ого и 2-ого законов термодинамики. Фундаментальное уравнение Гиббса для закрытых и открытых систем.
- •4. Константа скорости для реакций целого порядка и определение энергии активации по температурной зависимости константы скорости.
- •1. Основные структурные типы ионных соединений: NaCl, CsCl, CaF2.
- •2. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора.
- •3. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа.
- •4. Анализ фазовой диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •1. Энергия ионной кристаллической решётки. Цикл Борна-Габера.
- •2. Энтальпия и 1-ый закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость.
- •3. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Электродвижущая сила (эдс), ее связь с термодинамическими функциями.
- •4. Система кинетических уравнений по механизму реакции.
- •1. Радиусы атомов: ковалентные, металлические, ван-дер-ваальсовы. Радиусы ионов, способы их определения.
- •2. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях.
- •3. Параллельные обратимые реакции. Термодинамический и кинетический контроль.
- •4. Определение молярной массы растворенного вещества по коллигативным свойствам раствора.
- •1. Энергия ионной кристаллической решётки, её вычисление в рамках ионной модели.
- •2. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса.
- •3. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними.
- •3. Зависимость температуры кипения и плавления чистых веществ от давления. Уравнения Клапейрона и Клапейрона-Клаузиуса.
- •4. Расчёт плотности ионного кристалла по радиусам ионов и типу решётки.
3. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Переходный, или активированный комплекс – конфигурация ядер, соответствующая переходу от реагентов к продуктам.

Энергетическая кривая реакции.
Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики – законом действующих масс: скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
где k – константа скорости, зависящая только от температуры; x1,…xn – некоторые числа, которые называют порядком реакции по веществам A1,…An соответственно.
Методы определения порядка подразделяют на интегральные и дифференциальные в зависимости от того, используют они интегральные или дифференциальные кинетические уравнения для обработки экспериментальных данных о зависимости концентраций реагирующих веществ от времени. К интегральным методам относятся метод подстановки, метод Оствальда–Нойеса и метод полупревращения.
Метод подстановки заключается в том, что экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций целых порядков (от нулевого до третьего) и рассчитывают константу скорости.
Графический вариант метода подстановки заключается в представлении экспериментальных данных в соответствующих координатах для целых порядков.
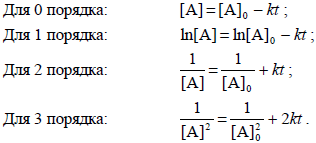
Если в координатах, соответствующих одному из порядков, получается линейная зависимость от времени, то изучаемая реакция имеет данный порядок. Одновременно из тангенса угла наклона прямой в этом случае можно получить значение константы скорости.
В методе Оствальда – Нойеса используют зависимость от начальной концентрации периода превращения τα исходного вещества на определенную долю α. Отношение периодов τα для двух начальных концентраций a1 и a2 равно
![]()
![]()

Частным случаем метода Оствальда – Нойеса является метод определения порядка реакции по периоду полупревращения (α = ½).

К дифференциальным методам относится метод Вант-Гоффа. Записав уравнение основного постулата химической кинетики в виде r = k[A]n, после логарифмирования получим
ln r = ln k + n ln [A].
Соответственно, из двух значений скорости реакции при двух концентрациях можно определить порядок реакции:
![]()
Применяют также графический вариант этого метода. Для этого строят зависимость ln r от ln[A]. Из тангенса угла наклона полученной прямой определяют порядок реакции, а из отсекаемого отрезка – константу скорости.
Если кинетическое уравнение реакции имеет вид r = k[A]α [B]β , то для определения порядка реакции по каждому из веществ используют метод изолирования Оствальда, или метод понижения порядка реакции. Суть метода состоит в том, что зависимость скорости реакции от начальной концентрации одного из реагентов (например, A) изучают при большом избытке второго реагента. В таком случае концентрация реагента B в течение реакции остается практически постоянной, и уравнение приобретает вид
![]()
где k*=k[B] β.
В лимитирующей стадии реакции могут участвовать реагенты А и В, хотя в уравнении скорости появляется только [А]. Это происходит при наличии большого избытка В, скажем, в 100 раз превышающего А по молярному объему. При этом па реакцию с А расходуется только 1 моль В, а 99 молей В остаются неизрасходованными. В таких случаях очень трудно измерить изменение концентрации В во времени, и это редко пытаются делать, особенно если В одновременно является растворителем. Поскольку концентрация избыточного реагента В практически не меняется во времени, реакция имеет кажущийся первый порядок по А, хотя в действительности и А и В участвуют в лимитирующей стадии. Такие реакции часто называют реакциями псевдопервого порядка. Псевдопорядок реакции возникает также в тех случаях, когда одним из реагентов является катализатор, концентрация которого не меняется во времени, так как он регенерируется так же быстро, как и расходуется, или когда реакцию проводят в среде, где поддерживается постоянная концентрация реагента.
Молекулярность – число ч-ц, участвующих в элементарной р-ии. В элементарной р-ии порядок равен молекулярности.
4. Энтальпия реакции по теплотам образования и (или) энергиям связи. H = U + pV. ΔrHT2= ΔrHT1 + ∫T1T2ΔrcpdT;
для реакции x*A + y*B = z*C :
Δrcp= z*cp(C) – x*cp(A) – y*cp(B) (например: Δrcp= 2cp(CO2) – 2*cp(CO) – cp(O2))
Билет 6.
