
- •1. Одноэлектронное приближение. Электронная конфигурация атома. Принципы заполнения одноэлектронных состояний.
- •2. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •3. Гетерогенный катализ: основные стадии, энергетический профиль.
- •4. Расчёт электродных потенциалов по уравнению Нернста.
- •1. Электронное состояние атома как целого. Квантовые числа. Атомные
- •2. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определения энтропии, их взаимосвязь.
- •3. Фотохимические реакции. Законы фотохимии. Квантовый выход. Примеры фотохимических реакций.
- •4. Анализ конкретной фазовой диаграммы двухкомпонентной системы.
- •Водородоподобные атомы. Уровни энергии и квантовые числа электрона.
- •2. Исходные постулаты термодинамики. Термические и калорические уравнения состояния.
- •3. Квазистационарное приближение в химической кинетике. Условия применимости, энергетические кривые.
- •4. Равновесный состав газовой смеси.
- •1. Электронные конфигурации переходных элементов 4-го периода и их ионов.
- •2. Коллигативные свойства растворов (электролиты и неэлектролиты).
- •3. Скорость химической реакции. Кинетическое уравнение. Закон действующих масс для элементарных реакций.
- •4. Энергии Гиббса химической реакции при различных температурах.
- •1. Электронные состояния двухатомных молекул. Характеристики кова-
- •2. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье.
- •3. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости.
- •1. Химическая связь и причины её образования. Кривые потенциальной энергии для двухатомной молекулы.
- •2. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •3. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •4. Порядок реакции по кинетическим данным.
- •1. Простейшие понятия теории молекулярных орбиталей. Метод молкао.
- •2. Электродвижущая сила (эдс), ее связь с термодинамическими функциями. Типы электрохимических ячеек.
- •3. Формальная кинетика реакций 1-го порядка. Решение прямой и обратной задачи.
- •4. Изменение энтропии в различных процессах (изменение температуры, объема, давления, фазовый переход, химическая реакция).
- •Теория мо. Электронные конфигурации молекул и молекулярных ионов водорода и гелия.
- •2. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •3. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •4. Константы скорости в параллельных реакциях.
- •1. Межмолекулярные взаимодействия и их классификация. Сравнение межмолекулярных
- •2. Третий закон термодинамики. Абсолютная энтропия.
- •3. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •4. Константа химического равновесия и равновесного состава смеси веществ.
- •Водородная связь и её характеристики. Примеры неорганических веществ с водородной связью.
- •2. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •3. Механизмы реакций. Решение кинетических уравнений для последовательных реакций первого порядка.
- •4. Фазовые диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •2. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Принцип независимости химических реакций. Составление и решение кинетических уравнений для обратимых реакций первого порядка.
- •4. Давления пара над чистым веществом и теплота фазового перехода.
- •1. Водородная связь и её характеристики. Влияние водородной связи на свойства органических веществ.
- •2. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •3. Механизм реакции. Составление и решение кинетических уравнений для параллельных реакций первого порядка.
- •4. Эмпирическая константа скорости и эффективная энергия активации сложной реакции.
- •1. Полиморфизм металлов (на примере железа или олова).
- •2. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •3. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •4. Состав пара над идеальным раствором.
- •1. Основные типы кристаллических решёток металлов. Плотнейшие шаровые упаковки.
- •2. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •3. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •4. Квантовый выход фотохимической реакции.
- •1. Структура ионных кристаллов. Ионная модель.
- •2. Объединение 1-ого и 2-ого законов термодинамики. Фундаментальное уравнение Гиббса для закрытых и открытых систем.
- •4. Константа скорости для реакций целого порядка и определение энергии активации по температурной зависимости константы скорости.
- •1. Основные структурные типы ионных соединений: NaCl, CsCl, CaF2.
- •2. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора.
- •3. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа.
- •4. Анализ фазовой диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •1. Энергия ионной кристаллической решётки. Цикл Борна-Габера.
- •2. Энтальпия и 1-ый закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость.
- •3. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Электродвижущая сила (эдс), ее связь с термодинамическими функциями.
- •4. Система кинетических уравнений по механизму реакции.
- •1. Радиусы атомов: ковалентные, металлические, ван-дер-ваальсовы. Радиусы ионов, способы их определения.
- •2. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях.
- •3. Параллельные обратимые реакции. Термодинамический и кинетический контроль.
- •4. Определение молярной массы растворенного вещества по коллигативным свойствам раствора.
- •1. Энергия ионной кристаллической решётки, её вычисление в рамках ионной модели.
- •2. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса.
- •3. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними.
- •3. Зависимость температуры кипения и плавления чистых веществ от давления. Уравнения Клапейрона и Клапейрона-Клаузиуса.
- •4. Расчёт плотности ионного кристалла по радиусам ионов и типу решётки.
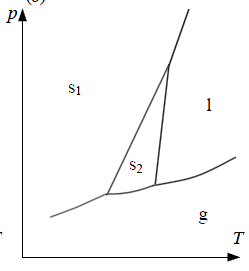
2. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
Диаграммы, выражающие зависимость состояния системы от внешних условий, называют диаграммами состояний, или фазовыми диаграммами системы.
Расчеты фазовых равновесий в однокомпонентных системах рассмотрим на примере системы, в которой образуются 4 фазы: две кристаллические (s1 и s2), жидкость (l) и газ (g).
Энергия Гиббса гетерогенной системы, состоящей из внутренне равновесных фаз в силу экстенсивности функции G, может быть записана в виде:
![]()
условие материального баланса: n = ns1 + ns2 + nl + ng.
В каждой точке кривой фазового равновесия выполняется условие:

где Δф.п.Hm – мольная энтальпия равновесного фазового перехода (плавления ΔплHm, испарения ΔиспHm, возгонки ΔсублHm, перехода между кристаллическими модификациями), Δф.п.Vm – разность мольных объемов фаз, находящихся в равновесии.
Для процессов испарения и возгонки уравнение можно преобразовать, считая, что мольным объемом конденсированной фазы (жидкости или твердого тела) Vконд можно пренебречь по сравнению с мольным объемом пара Vпар, а пар подчиняется уравнению состояния идеального газа. Подставляя (Vпар–Vконд)≈Vпар=RT/p, получаем уравнение Клаузиуса–Клапейрона:
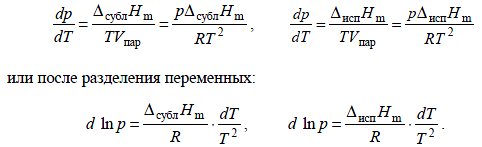
Мольные энтальпии возгонки, плавления и испарения при фиксированной температуре связаны соотношением:
ΔсублH = ΔплH + ΔиспH.
3. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
Уравнение химической реакции – условная запись реакции посредством химических формул и математических знаков. Коэффициенты перед молекулами веществ в уравнениях – стехиометрические коэффициенты. Стехиометрическое соотношение – численное соотношение между количествами реагирующих веществ, отвечающим законам стехиометрии. Стехиометрические соотношения выражаются целыми числами для подавляющего числа веществ ( у твердых – бывают дробные). Согласно закону кратных отношений изменения количества составляющих в реакции должны быть пропорциональны стехиометрическим коэффициентам в уравнении реакции. Коэффициент пропорциональности называется химической переменной.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Переходный, или активированный комплекс – конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходному комплексу отвечает область вблизи максимума на энергетической кривой химической реакции.

Энергетические кривые реакции.
4. Квантовый выход фотохимической реакции.
Эффективность фотохимической реакции характеризуют квантовым выходом, который равен отношению числа прореагировавших молекул к числу поглощенных фотонов: φ = N(молекул) / N(hν).
Билет 16.
1. Структура ионных кристаллов. Ионная модель.
