
- •1. Одноэлектронное приближение. Электронная конфигурация атома. Принципы заполнения одноэлектронных состояний.
- •2. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •3. Гетерогенный катализ: основные стадии, энергетический профиль.
- •4. Расчёт электродных потенциалов по уравнению Нернста.
- •1. Электронное состояние атома как целого. Квантовые числа. Атомные
- •2. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определения энтропии, их взаимосвязь.
- •3. Фотохимические реакции. Законы фотохимии. Квантовый выход. Примеры фотохимических реакций.
- •4. Анализ конкретной фазовой диаграммы двухкомпонентной системы.
- •Водородоподобные атомы. Уровни энергии и квантовые числа электрона.
- •2. Исходные постулаты термодинамики. Термические и калорические уравнения состояния.
- •3. Квазистационарное приближение в химической кинетике. Условия применимости, энергетические кривые.
- •4. Равновесный состав газовой смеси.
- •1. Электронные конфигурации переходных элементов 4-го периода и их ионов.
- •2. Коллигативные свойства растворов (электролиты и неэлектролиты).
- •3. Скорость химической реакции. Кинетическое уравнение. Закон действующих масс для элементарных реакций.
- •4. Энергии Гиббса химической реакции при различных температурах.
- •1. Электронные состояния двухатомных молекул. Характеристики кова-
- •2. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье.
- •3. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости.
- •1. Химическая связь и причины её образования. Кривые потенциальной энергии для двухатомной молекулы.
- •2. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •3. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •4. Порядок реакции по кинетическим данным.
- •1. Простейшие понятия теории молекулярных орбиталей. Метод молкао.
- •2. Электродвижущая сила (эдс), ее связь с термодинамическими функциями. Типы электрохимических ячеек.
- •3. Формальная кинетика реакций 1-го порядка. Решение прямой и обратной задачи.
- •4. Изменение энтропии в различных процессах (изменение температуры, объема, давления, фазовый переход, химическая реакция).
- •Теория мо. Электронные конфигурации молекул и молекулярных ионов водорода и гелия.
- •2. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •3. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •4. Константы скорости в параллельных реакциях.
- •1. Межмолекулярные взаимодействия и их классификация. Сравнение межмолекулярных
- •2. Третий закон термодинамики. Абсолютная энтропия.
- •3. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •4. Константа химического равновесия и равновесного состава смеси веществ.
- •Водородная связь и её характеристики. Примеры неорганических веществ с водородной связью.
- •2. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •3. Механизмы реакций. Решение кинетических уравнений для последовательных реакций первого порядка.
- •4. Фазовые диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •2. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Принцип независимости химических реакций. Составление и решение кинетических уравнений для обратимых реакций первого порядка.
- •4. Давления пара над чистым веществом и теплота фазового перехода.
- •1. Водородная связь и её характеристики. Влияние водородной связи на свойства органических веществ.
- •2. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •3. Механизм реакции. Составление и решение кинетических уравнений для параллельных реакций первого порядка.
- •4. Эмпирическая константа скорости и эффективная энергия активации сложной реакции.
- •1. Полиморфизм металлов (на примере железа или олова).
- •2. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •3. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •4. Состав пара над идеальным раствором.
- •1. Основные типы кристаллических решёток металлов. Плотнейшие шаровые упаковки.
- •2. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •3. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •4. Квантовый выход фотохимической реакции.
- •1. Структура ионных кристаллов. Ионная модель.
- •2. Объединение 1-ого и 2-ого законов термодинамики. Фундаментальное уравнение Гиббса для закрытых и открытых систем.
- •4. Константа скорости для реакций целого порядка и определение энергии активации по температурной зависимости константы скорости.
- •1. Основные структурные типы ионных соединений: NaCl, CsCl, CaF2.
- •2. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора.
- •3. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа.
- •4. Анализ фазовой диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •1. Энергия ионной кристаллической решётки. Цикл Борна-Габера.
- •2. Энтальпия и 1-ый закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость.
- •3. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Электродвижущая сила (эдс), ее связь с термодинамическими функциями.
- •4. Система кинетических уравнений по механизму реакции.
- •1. Радиусы атомов: ковалентные, металлические, ван-дер-ваальсовы. Радиусы ионов, способы их определения.
- •2. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях.
- •3. Параллельные обратимые реакции. Термодинамический и кинетический контроль.
- •4. Определение молярной массы растворенного вещества по коллигативным свойствам раствора.
- •1. Энергия ионной кристаллической решётки, её вычисление в рамках ионной модели.
- •2. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса.
- •3. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними.
- •3. Зависимость температуры кипения и плавления чистых веществ от давления. Уравнения Клапейрона и Клапейрона-Клаузиуса.
- •4. Расчёт плотности ионного кристалла по радиусам ионов и типу решётки.
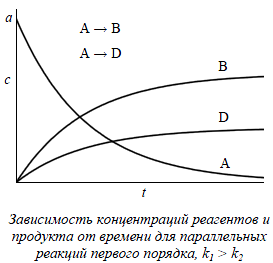
3. Механизм реакции. Составление и решение кинетических уравнений для параллельных реакций первого порядка.
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций: если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Параллельные реакции:
Кинетическое уравнение записывается с учетом принципа независимости:
![]()
Решение этого уравнения записывается так же, как и для одной реакции первого порядка:

Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
![]()
4. Зависимость температуры фазового перехода от давления.
Билет 13.
1. Кристаллические твёрдые тела и их классификация. Элементарная ячейка.
2. Вычисление абсолютной энтропии из экспериментальных данных.
Для расчета абсолютной энтропии веществ в стандартном состоянии надо знать зависимости теплоемкости Cp от температуры для каждой из фаз, а также температуры и энтальпии фазовых переходов. Так, например, абсолютная энтропия газообразного вещества в стандартном состоянии при температуре T складывается из следующих составляющих:

3. Гетерогенные системы. Фазовый состав. Условия фазового равновесия. Правило фаз Гиббса.
Вещества, образующие термодинамическую систему, могут находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Система, между частями которой нет поверхностей раздела, а интенсивные свойства одинаковы в любых точках, называется гомогенной. Если части системы разграничены поверхностями раздела, на которых происходит скачкообразное изменение некоторых свойств, то такие системы относят к гетерогенным. Любая гетерогенная система состоит из нескольких фаз. Фаза – гомогенная часть гетерогенной системы, ограниченная поверхностью раздела. Фаза может быть образована одним или несколькими составляющими веществами. Составляющими называют любые структурные единицы, которые отражают количественный и качественный состав фазы. Компоненты – это минимальный набор веществ, достаточный для получения всех других составляющих.
Фазы и составляющие вещества выбирают на основании результатов фазового или химического анализов. Для определения компонентов и независимых реакций в сложных системах необходимо дополнительно располагать сведениями о кинетике взаимных превращений составляющих веществ. Если какие-либо из составляющих не вступают в химические реакции по кинетическим причинам или неподвижны (т.е. не могут перемещаться из одной фазы в другую), то такие вещества всегда считаются компонентами. Если кинетические ограничения отсутствуют, то процедуру выбора компонентов можно формализовать с использованием методов линейной алгебры. Так, в случае гомогенной системы число компонентов равно рангу формульной матрицы, а число независимых реакций – разности между числом составляющих и компонентов.
В гетерогенных системах числа компонентов и фаз связаны между собой соотношением, получившим название правила фаз Гиббса.
Рассмотрим закрытую систему, состоящую из К компонентов, каждый из которых может находиться в Ф фазах. Определим число степеней свободы системы, С, как число переменных, которые можно варьировать, не изменяя фазового состояния системы. Оно равно разности между общим количеством переменных, описывающих состояние системы, и числом уравнений, связывающих эти переменные. Состояние системы определено, если заданы количества компонентов и параметры, характеризующие силовые (термический, механический и т.п.) контакты системы с окружением. Число таких контактов (обозначим их через m) равно числу слагаемых Pjdxj в правой части уравнения
![]()
В каждой фазе независимыми являются (K – 1) концентраций компонентов (поскольку сумма мольных долей компонентов в каждой фазе равна единице). Если число фаз равно Ф, то общее число переменных, необходимых для полного описания состояния системы, составляет {m + Ф(К − 1)}. При этом следует принимать во внимание наличие К(Ф – 1) уравнений связи между этими переменными:

Если имеются и другие условия связи между переменными (обозначим их n), то их также необходимо учитывать при определении числа степеней свободы системы. Например, если в системе протекают химические реакции, то n равно числу независимых уравнений реакций. В общем случае число независимых переменных будет равно:
С = m + Ф(К − 1) − К(Ф – 1) – n = m – n + K − Ф.
Полученное выражение называют правилом фаз Гиббса. Если m = 2 (термическое и механическое равновесия) и отсутствуют дополнительные условия связи (n = 0), то приходим к наиболее распространенной форме записи правила фаз
С = K − Ф + 2.
Присутствие в системе неподвижных компонентов никак не отражается на числе степеней свободы, так как такие компоненты не участвуют в химических контактах между фазами.
