
- •1. Одноэлектронное приближение. Электронная конфигурация атома. Принципы заполнения одноэлектронных состояний.
- •2. Закон Рауля. Давление пара над идеальным раствором. Предельно разбавленные растворы. Закон Генри.
- •3. Гетерогенный катализ: основные стадии, энергетический профиль.
- •4. Расчёт электродных потенциалов по уравнению Нернста.
- •1. Электронное состояние атома как целого. Квантовые числа. Атомные
- •2. Энтропия и 2-й закон термодинамики. Термодинамическое и статистическое определения энтропии, их взаимосвязь.
- •3. Фотохимические реакции. Законы фотохимии. Квантовый выход. Примеры фотохимических реакций.
- •4. Анализ конкретной фазовой диаграммы двухкомпонентной системы.
- •Водородоподобные атомы. Уровни энергии и квантовые числа электрона.
- •2. Исходные постулаты термодинамики. Термические и калорические уравнения состояния.
- •3. Квазистационарное приближение в химической кинетике. Условия применимости, энергетические кривые.
- •4. Равновесный состав газовой смеси.
- •1. Электронные конфигурации переходных элементов 4-го периода и их ионов.
- •2. Коллигативные свойства растворов (электролиты и неэлектролиты).
- •3. Скорость химической реакции. Кинетическое уравнение. Закон действующих масс для элементарных реакций.
- •4. Энергии Гиббса химической реакции при различных температурах.
- •1. Электронные состояния двухатомных молекул. Характеристики кова-
- •2. Связь константы равновесия с изменением термодинамических функций в реакции. Зависимость константы равновесия от температуры. Принцип Ле Шателье.
- •3. Константа скорости. Порядок, псевдопорядок и молекулярность реакции. Экспериментальное определение порядка реакции и константы скорости.
- •1. Химическая связь и причины её образования. Кривые потенциальной энергии для двухатомной молекулы.
- •2. Электродные потенциалы, их зависимость от концентраций (активностей) ионов и температуры. Стандартные электродные потенциалы.
- •3. Тепловой эффект химической реакции. Закон Гесса. Энтальпия образования.
- •4. Порядок реакции по кинетическим данным.
- •1. Простейшие понятия теории молекулярных орбиталей. Метод молкао.
- •2. Электродвижущая сила (эдс), ее связь с термодинамическими функциями. Типы электрохимических ячеек.
- •3. Формальная кинетика реакций 1-го порядка. Решение прямой и обратной задачи.
- •4. Изменение энтропии в различных процессах (изменение температуры, объема, давления, фазовый переход, химическая реакция).
- •Теория мо. Электронные конфигурации молекул и молекулярных ионов водорода и гелия.
- •2. Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).
- •3. Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
- •4. Константы скорости в параллельных реакциях.
- •1. Межмолекулярные взаимодействия и их классификация. Сравнение межмолекулярных
- •2. Третий закон термодинамики. Абсолютная энтропия.
- •3. Влияние температуры на скорость реакции. Уравнение Аррениуса, его интегральная и дифференциальная формы. Опытная энергия активации.
- •4. Константа химического равновесия и равновесного состава смеси веществ.
- •Водородная связь и её характеристики. Примеры неорганических веществ с водородной связью.
- •2. Термодинамические системы и их классификация. Экстенсивные и интенсивные величины. Функции состояния и функции процесса. Термодинамические координаты и силы.
- •3. Механизмы реакций. Решение кинетических уравнений для последовательных реакций первого порядка.
- •4. Фазовые диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •2. Фундаментальное уравнение Гиббса в переменных t, V. Критерии самопроизвольности процесса и равновесия.
- •2. Принцип независимости химических реакций. Составление и решение кинетических уравнений для обратимых реакций первого порядка.
- •4. Давления пара над чистым веществом и теплота фазового перехода.
- •1. Водородная связь и её характеристики. Влияние водородной связи на свойства органических веществ.
- •2. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
- •3. Механизм реакции. Составление и решение кинетических уравнений для параллельных реакций первого порядка.
- •4. Эмпирическая константа скорости и эффективная энергия активации сложной реакции.
- •1. Полиморфизм металлов (на примере железа или олова).
- •2. Внутренняя энергия и 1-й закон термодинамики в переменных t, V. Тепловой эффект процесса при постоянном объеме или давлении. Калорические коэффициенты.
- •3. Фотохимические реакции. Первичные процессы при возбуждении: фотофизические и фотохимические. Кинетика фотохимических реакций. Отличие фотохимических реакций от темновых.
- •4. Состав пара над идеальным раствором.
- •1. Основные типы кристаллических решёток металлов. Плотнейшие шаровые упаковки.
- •2. Фазовые диаграммы однокомпонентных систем. Уравнение Клапейрона-Клаузиуса.
- •3. Уравнения химических реакций. Стехиометрические соотношения. Химическая переменная. Энергетическая кривая химической реакции (элементарной и двухстадийной).
- •4. Квантовый выход фотохимической реакции.
- •1. Структура ионных кристаллов. Ионная модель.
- •2. Объединение 1-ого и 2-ого законов термодинамики. Фундаментальное уравнение Гиббса для закрытых и открытых систем.
- •4. Константа скорости для реакций целого порядка и определение энергии активации по температурной зависимости константы скорости.
- •1. Основные структурные типы ионных соединений: NaCl, CsCl, CaF2.
- •2. Химический потенциал компонента идеального раствора. Термодинамические функции образования идеального раствора.
- •3. Основные понятия катализа. Классификация каталитических реакций. Гомогенный катализ. Общий механизм катализа.
- •4. Анализ фазовой диаграммы одно- или двухкомпонентной системы на основе правила фаз Гиббса.
- •1. Энергия ионной кристаллической решётки. Цикл Борна-Габера.
- •2. Энтальпия и 1-ый закон термодинамики в переменных t, p. Тепловой эффект процесса при постоянном давлении. Изобарная теплоемкость.
- •3. Электроды и полуреакции. Основные типы электродов. Стандартные электродные потенциалы. Электродвижущая сила (эдс), ее связь с термодинамическими функциями.
- •4. Система кинетических уравнений по механизму реакции.
- •1. Радиусы атомов: ковалентные, металлические, ван-дер-ваальсовы. Радиусы ионов, способы их определения.
- •2. Стандартные состояния и термодинамические функции индивидуальных веществ. Оператор химической реакции. Изменение термодинамических функций в химических реакциях.
- •3. Параллельные обратимые реакции. Термодинамический и кинетический контроль.
- •4. Определение молярной массы растворенного вещества по коллигативным свойствам раствора.
- •1. Энергия ионной кристаллической решётки, её вычисление в рамках ионной модели.
- •2. Энтропия как функция состояния и как критерий направленности самопроизвольного процесса.
- •3. Условия химического равновесия. Закон действующих масс для идеально-газовой смеси. Константы равновесия и связь между ними.
- •3. Зависимость температуры кипения и плавления чистых веществ от давления. Уравнения Клапейрона и Клапейрона-Клаузиуса.
- •4. Расчёт плотности ионного кристалла по радиусам ионов и типу решётки.
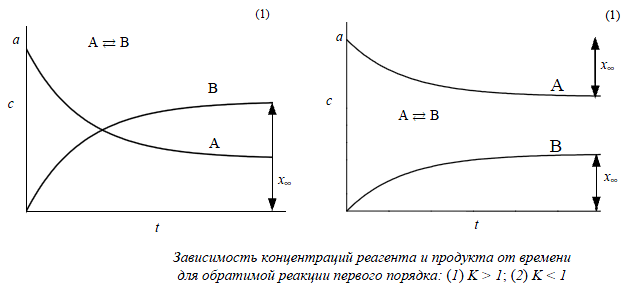
2. Принцип независимости химических реакций. Составление и решение кинетических уравнений для обратимых реакций первого порядка.
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций: если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Обратимые реакции:
Эта схема описывает реакции изомеризации в газовой фазе или в растворе, например: цис-стильбен транс-стильбен, бутан изобутан.
Закон действующих масс записывается следующим образом:
![]()
Если начальные концентрации веществ A и B обозначить, соответственно, a и b и ввести степень превращения x ([A] = a – x, [B] = b + x), то кинетическое уравнение приобретает вид:
![]()
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
 ,
,
где x∞ определяется условием равенства скоростей прямой и обратной реакций:

Уравнения для обратимой реакции первого порядка имеют такой же вид, как и для необратимой реакции с той разницей, что вместо начальной концентрации фигурирует равновесная, а константу скорости необратимой реакции заменяет сумма констант для прямой и обратной реакций.
При t →∞ наступает равновесие, которое характеризуется константой:
![]()
4. Давления пара над чистым веществом и теплота фазового перехода.
μi(pi)= μiø + RT ln(pi/po); ΔU = Qф.пер + рΔV. d(lnp)/dT=ΔHф.п/RT2
Билет 12.
1. Водородная связь и её характеристики. Влияние водородной связи на свойства органических веществ.
2. Химический потенциал, определение. Идеальные растворы. Термодинамика смешения. Активность и коэффициенты активности.
Зависимость термодинамических потенциалов от их естественных переменных описывается основными уравнениями термодинамики – фундаментальными уравнениями Гиббса. В дифференциальной форме
эти уравнения имеют вид:


где химический потенциал

характеризует приращение соответствующего термодинамического потенциала при изменении количества данного вещества и постоянстве естественных переменных и количеств остальных веществ. Равенство химических потенциалов веществ является признаком их химического равновесия; разность химических потенциалов является движущей силой при массопереносе.
Удобной системой сравнения свойств раствора является идеальный раствор. Под идеальным обычно понимают раствор, для компонентов которого при всех составах и температурах выполняется закон Рауля.
Согласно закону Рауля, давление пара растворителя pi над раствором пропорционально мольной доле растворителя xi в растворе:
pi=pisxi,
где pi – давление насыщенного пара компонента над раствором, pis – давление насыщенного пара над чистым компонентом, xi – мольная доля i-го компонента в растворе.
Признаком идеальности раствора является аддитивность парциальных давлений, парциальных объемов, теплоемкостей и энтальпий компонентов. Тепловой эффект при образовании идеального раствора равен нулю, объем не изменяется, а энтропия равна идеальной энтропии смешения.

Для описания свойств реальных растворов вводится понятие активности. Активность ai – безразмерная величина, определяемая через разность химических потенциалов этого вещества в данной фазе и в стандартном состоянии:
![]()
Если пар вещества ведет себя как идеальный газ, то активность можно определить через экспериментально измеряемые величины:
![]()
где pi – давление насыщенного пара i-го компонента над раствором, pis – давление насыщенного пара чистого i-го вещества при той же температуре T и в том же фазовом состоянии, что и раствор.
Активность ai выражается в виде произведения мольной доли xi компонента на его коэффициент активности γi:
ai = γixi.
Если активность выражать через разные концентрации, соответственно, будет изменяться и значение коэффициента активности γ:
a = γxx = γcc = γmm.
Коэффициенты активности – безразмерные величины, характеризующие работу, которую надо совершить при перемещении i-го компонента из идеального раствора в реальный при постоянной температуре, давлении и концентрации. В зависимости от выбранной системы сравнения, коэффициенты активности компонентов определяют на основании отклонений парциальных давлений паров компонентов от закона Рауля или от закона Генри.
