
- •Глава 3. Реальные газы
- •3.1. Экспериментальные изотермы. Критическая точка
- •3.2. Кривая равновесия жидкость – пар
- •3.3. Уравнение Клапейрона – Клаузиуса
- •3.4. Уравнение Ван-дер-Ваальса
- •3.5. Опытное определение констант уравнения Ван-дер-Ваальса
- •3.6. Изотермы Ван-дер-Ваальса и сравнение их с экспериментальными изотермами
- •3.7. Внутренняя энергия газа Ван-дер-Ваальса
- •3.8. Эффект Джоуля – Томсона
- •3.9. Эффект Джоуля – Томсона в газе Ван-дер-Ваальса
- •3.10. Сжижение газов. Получение низких и сверхнизких температур
Глава 3. Реальные газы
3.1. Экспериментальные изотермы. Критическая точка
Реальные газы отличаются от идеальных тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой сложными силами взаимодействия. При высоких давлениях и достаточно низких температурах реальные газы конденсируются, т. е. переходят в жидкое состояние, чего принципиально не может быть с идеальными газами.
В 1861 году ирландский физико-химик Т. Эндрюс экспериментально исследовал зависимость давления углекислого газа от объема при изотермическом сжатии. На рис. 47 схематично представлены результаты опытов, подобных опытам Т. Эндрюса. Рассмотрим изотерму АВСD.
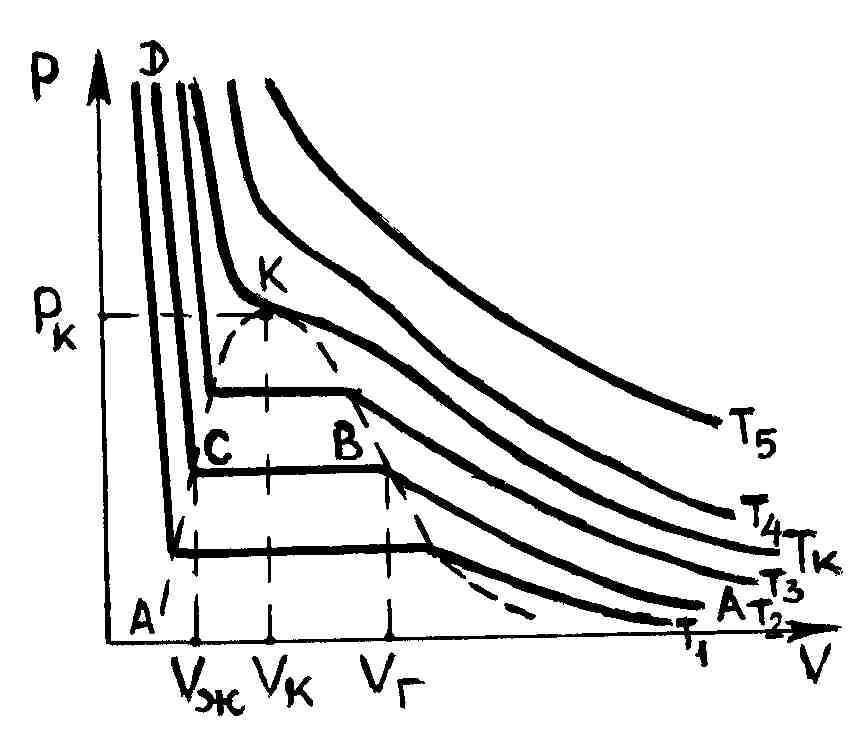
Р и с. 47
На участке АВ уменьшение объема, занятого газом, сопровождается увеличением давления сначала обратно пропорционально объему, затем все медленнее.
В точке В начинается конденсация газа и продолжается при постоянном давлении, называемом давлением насыщенных паров, до точки С. В точке С процесс конденсации газа заканчивается, при дальнейшем уме-ньшении объема осуществляется сжатие жидкости (участок СD), сопровождающееся быстрым ростом давления, свидетельствующее о том, что жидкость слабо сжимаема. При уменьшении давления, действующего на жидкость, вещество пройдет те же состояния в обратном порядке: оно расширится по пути DС до точки кипения, произойдет испарение (путь СВ), а затем получившийся пар расширится до исходного давления (точка А).
На
участке ВС не только давление, но и
температура постоянны. Крайним точкам
отрезка ВС соответствуют однофазные
состояния вещества: точке С (объем
![]() )
– жидкое, а точке В (объем
)
– жидкое, а точке В (объем
![]() )
– газообразное. В промежуточном
двухфазном состоянии с объемом V
часть вещества с количеством молей
)
– газообразное. В промежуточном
двухфазном состоянии с объемом V
часть вещества с количеством молей
![]() находится в жидком, а часть с количеством
молей
находится в жидком, а часть с количеством
молей
![]() – в газообразном состоянии. Определим
отношение количества молей жидкой и
газообразной фаз в объеме
– в газообразном состоянии. Определим
отношение количества молей жидкой и
газообразной фаз в объеме
![]() .
.
Объем одного моля жидкой и газообразной фаз вещества соответственно равны:
![]()
![]() . (3.1.1)
. (3.1.1)
Объем V содержит молей жидкой фазы и молей газообразной фазы, поэтому этот объем можно представить в виде суммы объемов жидкой и газообразной фаз следующим образом:
 . (3.1.2)
. (3.1.2)
После простых преобразований из выражения (3.1.2) находим искомое отношение
 . (3.1.3)
. (3.1.3)
Умножая
числитель и знаменатель левой части
выражения (3.1.3) на молярную массу
![]() вещества, получим аналогичное отношение
для масс жидкой и газообразной фаз:
вещества, получим аналогичное отношение
для масс жидкой и газообразной фаз:
 . (3.1.4)
. (3.1.4)
Таким образом, отношение масс жидкости и насыщенного пара в произвольном двухфазном состоянии определяемом объемом , равно отношению отрезков, на которое делит участок ВС точка, соответствующая объему (рис. 47). Из формулы (3.1.4) легко видеть, что, чем ближе значение молярного объема к , тем большая часть вещества находится в жидком состоянии и тем меньшая – в газообразном. И, наоборот, чем ближе объем к , тем большая часть вещества находится в газообразном состоянии, и тем меньшая его часть приходится на жидкость.
На
рис. 47 представлены изотермы газа при
различных температурах
![]() Из рисунка видно, что с ростом температуры
горизонтальный участок, соответствующий
двухфазному состоянию вещества,
уменьшается и при некоторой температуре
Из рисунка видно, что с ростом температуры
горизонтальный участок, соответствующий
двухфазному состоянию вещества,
уменьшается и при некоторой температуре
![]() ,
называемой критической, стягивается в
точку
,
называемой критической, стягивается в
точку
![]() .
Изотерма, соответствующая температуре
,
называется критической изотермой, точка
которой является точкой перегиба.
.
Изотерма, соответствующая температуре
,
называется критической изотермой, точка
которой является точкой перегиба.
Из
рис. 47 также видно, что с ростом температуры
растет молярный объем
![]() ,
занимаемый жидкостью, что равносильно
уменьшению ее плотности
,
занимаемый жидкостью, что равносильно
уменьшению ее плотности
![]() .
И, наоборот, с ростом температуры
уменьшается молярный объем
,
занимаемый газом, что равнозначно
увеличению его плотности
.
И, наоборот, с ростом температуры
уменьшается молярный объем
,
занимаемый газом, что равнозначно
увеличению его плотности
![]() .
В критическом состоянии
.
В критическом состоянии
![]() и
и
![]() т. е. в состоянии, определяемом критическими
параметрами
т. е. в состоянии, определяемом критическими
параметрами
![]() ,
исчезает всякое различие между жидкостью
и ее насыщенным паром.
,
исчезает всякое различие между жидкостью
и ее насыщенным паром.
При
температурах, больших критической,
отсутствует область двухфазных состояний,
вещество находится в газообразном
состоянии. Это объясняется тем, что при
температурах
![]() ,
кинетическая энергия поступательного
движения молекул намного больше
потенциальной энергии их взаимодействия
и, естественно, вещество в таких условиях
может находиться только в виде газа.
Следовательно, даже сверхвысокими
давлениями невозможно газ перевести в
жидкое состояние, если его температура
выше критической. Поэтому в XIX
в. потерпели неудачу первые попытки
сжижения некоторых газов, так как
комнатная температура, при которой
начиналось их сжатие, была значительно
больше критической температуры. В
качестве примера приведем экспериментальные
значения критической температуры для
некоторых веществ: для воды
,
кинетическая энергия поступательного
движения молекул намного больше
потенциальной энергии их взаимодействия
и, естественно, вещество в таких условиях
может находиться только в виде газа.
Следовательно, даже сверхвысокими
давлениями невозможно газ перевести в
жидкое состояние, если его температура
выше критической. Поэтому в XIX
в. потерпели неудачу первые попытки
сжижения некоторых газов, так как
комнатная температура, при которой
начиналось их сжатие, была значительно
больше критической температуры. В
качестве примера приведем экспериментальные
значения критической температуры для
некоторых веществ: для воды
![]() для углекислого газа
для углекислого газа
![]() ,
для кислорода
,
для кислорода
![]() ,
для азота
,
для азота
![]() для водорода
для водорода
![]() ,
для гелия
,
для гелия
![]() .
Как видно из приведенных чисел, выбор
Т. Эндрюсом углекислого газа для опытов
был весьма удачен.
.
Как видно из приведенных чисел, выбор
Т. Эндрюсом углекислого газа для опытов
был весьма удачен.
Если
соединить между собой левые концы
горизонтальных участков опытных изотерм,
соответствующих двухфазному состоянию
вещества, а затем то же самое проделать
с правыми концами, то получится
колокольного вида кривая АKВ,
которая совместно с частью DK
критической изотермы разделит плоскость
![]() на три области (рис. 48).
на три области (рис. 48).

Р и с. 48
Пограничная
кривая AK, называемая
кривой кипения, отделяет однофазную
область 1 жидкого состояния вещества
от двухфазной области 2 насыщенного
пара. Пограничная кривая конденсации
BK отделяет двухфазную
область 2 от однофазной области 3
газообразного состояния вещества. При
давлениях, больших критического
![]() ,
отсутствует область двухфазного
состояния. Вещество в этом случае может
находиться или в газообразном или в
жидком состоянии. Границей между ними
служит часть DK
критической изотермы.
,
отсутствует область двухфазного
состояния. Вещество в этом случае может
находиться или в газообразном или в
жидком состоянии. Границей между ними
служит часть DK
критической изотермы.
Наличие
критической изотермы четко показывает,
что между жидким и газообразным
состояниями вещества нет принципиального
качественного различия. В самом деле,
из газообразного состояния
![]() вещество можно перевести в жидкое
состояние
вещество можно перевести в жидкое
состояние
![]() ,
по пути
,
по пути
![]() минуя область 2 двухфазного состояния
(рис. 48). При этом нигде не будет происходить
скачкообразное изменение состояния,
вещество будет на всем пути перехода
однородным.
минуя область 2 двухфазного состояния
(рис. 48). При этом нигде не будет происходить
скачкообразное изменение состояния,
вещество будет на всем пути перехода
однородным.
