
Вопрос№15. Определение термодинамической функции
Все
расчеты в термодинамике основываются
на использовании функций состояния,
называемых термодинамическими функциями.
Каждому наборунезависимых параметров
соответствует своя термодинамическая
функция. Изменения функций, происходящие
в ходе каких-либо процессов, определяют
либо совершаемую системой работу,
либо получаемую системой теплоту.
Термодинамические
функции являются функциями состояния.
Поэтому приращение любой из функции равно
полному дифференциалу функции, которой
она выражается. Полный дифференциал
функции f(x,у)
переменных х и у определяется
выражением
![]() (1)
Поэтому,
если в ходе преобразований мы получим
для приращёния некоторой
величины f выражение
вида
(1)
Поэтому,
если в ходе преобразований мы получим
для приращёния некоторой
величины f выражение
вида
![]() (2)
можно
утверждать, что эта величина является
функцией параметров
(2)
можно
утверждать, что эта величина является
функцией параметров ![]() и
и![]() ,
причем функции
,
причем функции ![]() и
и ![]() представляют
собой частные производные
функции
представляют
собой частные производные
функции![]() :
:
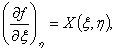
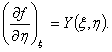 (3)
При
рассмотрении термодинамических
функций мы
будем пользоваться неравенством
Клаузиуса, представив его
в виде
(3)
При
рассмотрении термодинамических
функций мы
будем пользоваться неравенством
Клаузиуса, представив его
в виде
![]() (4)
Знак
равенства относится к обратимым, знак
неравенства - к необратимым процессам.
(4)
Знак
равенства относится к обратимым, знак
неравенства - к необратимым процессам.
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическомизотермическом процессе равна работе, совершённой системой над внешними телами.
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
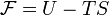 ,
где
,
где 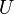 — внутренняя
энергия,
— внутренняя
энергия, 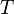 —
абсолютная температура,
—
абсолютная температура, 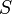 — энтропия.
— энтропия.
Отсюда дифференциал свободной энергии равен:
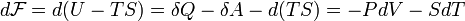 .
.
Видно, что
это выражение является полным
дифференциалом относительно независимых
переменных
и ![]() .
Поэтому часто свободную энергию
Гельмгольца для равновесного состояния
выражают как функцию
.
Поэтому часто свободную энергию
Гельмгольца для равновесного состояния
выражают как функцию ![]() .
.
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
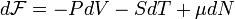 ,
,
где ![]() — химический
потенциал,
а
— химический
потенциал,
а ![]() —
число частиц в системе. При этом свободная
энергия Гельмгольца для равновесного
состояния записывается как функция
—
число частиц в системе. При этом свободная
энергия Гельмгольца для равновесного
состояния записывается как функция ![]() .
.
В приложениях «свободной энергией» иногда называют не свободную энергию Гельмгольца, а энергию Гиббса. Это связано с тем, что энергия Гиббса также является мерой максимальной работы, но в данном случае рассматривается только работа над внешними телами, исключая среду:
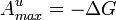 ,
где
,
где 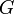 —
энергия Гиббса.
—
энергия Гиббса.Электрохимический потенциал — физическая величина, связывающая химический потенциал (μ) и электрический потенциал (φ) некоторой электрохимической системы соотношением:
A = μ + e·φ
где А — работа, нарушающая электрохимическое равновесие системы; e — элементарный заряд частицы.
Для растворенного вещества:
μ = μ0 + R*T*lnC + z*F*φ
где
μ0 - Стандартный химический потенциал, зависящий от природы растворителя.
С - концентрация вещества
R - газовая постоянная
T - температура
z - валентность иона
F - число Фарадея
φ - электрический потенциал
![]() или
или
![]() (1)
Уравнение
(1) выражает первое
начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил. Выражение (1) в дифференциальной
форме будет иметь вид
(1)
Уравнение
(1) выражает первое
начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил. Выражение (1) в дифференциальной
форме будет иметь вид
![]() или
в более корректной форме
(2)
где
dU — бесконечно малое изменение
(приращение) внутренней энергии системы,
δA — элементарная работа, δQ — бесконечно
малое количество теплоты. В этом выражении
dU является полным дифференциалом, а δA
и δQ таковыми не являются. В дальнейшем
будем использовать запись первого
начала термодинамики в форме (2).
Из
формулы (1) мы видим, что в СИ количество
теплоты выражается в тех же единицах,
что работа и энергия, т. е. в джоулях
(Дж).
Если
система периодически возвращается в
первоначальное состояние, то изменение
ее внутренней энергии равно нулю: ΔU=0.
Тогда, согласно первому началу
термодинамики,
или
в более корректной форме
(2)
где
dU — бесконечно малое изменение
(приращение) внутренней энергии системы,
δA — элементарная работа, δQ — бесконечно
малое количество теплоты. В этом выражении
dU является полным дифференциалом, а δA
и δQ таковыми не являются. В дальнейшем
будем использовать запись первого
начала термодинамики в форме (2).
Из
формулы (1) мы видим, что в СИ количество
теплоты выражается в тех же единицах,
что работа и энергия, т. е. в джоулях
(Дж).
Если
система периодически возвращается в
первоначальное состояние, то изменение
ее внутренней энергии равно нулю: ΔU=0.
Тогда, согласно первому началу
термодинамики,
![]() т.
е. вечный двигатель первого рода —
периодически действующий двигатель,
совершающий бoльшую работу, чем сообщенная
ему извне энергия, — невозможен (одна
из формулировок первого начала
термодинамики).
т.
е. вечный двигатель первого рода —
периодически действующий двигатель,
совершающий бoльшую работу, чем сообщенная
ему извне энергия, — невозможен (одна
из формулировок первого начала
термодинамики).
