
73. Энергетические уровни молекул
Молекулярные спектры гораздо сложнее и разнообразнее атомных. Это обусловлено тем, что в молекулах имеются дополнительные степени свободы и наряду с движением электронов вокруг ядер атомов, образующих молекулу, происходят колебания самих ядер относительно равновесного положения, а также вращение молекулы как целого. Ядра в молекуле образуют линейную, плоскую или трехмерную конфигурацию. Плоская и трехмерная молекулы, состоящие из N атомов, обладают 3N-6 колебательными и тремя вращательными степенями свободы, а линейная - 3N-5 колебательными и двумя вращательными степенями свободы. Таким образом, молекула кроме электронной энергии имеет колебательную и вращательную внутренние энергии, а также новые системы уровней.

Комбинационное рассеяние света (эффект Рамана) — неупругое рассеяние оптического излучения на молекулах вещества (твёрдого, жидкого или газообразного), сопровождающееся заметным изменением частоты излучения. В отличие от рэлеевского рассеяния, в случае комбинационного рассеяния света в спектре рассеянного излучения появляются спектральные линии, которых нет в спектре первичного (возбуждающего) света. Число и расположение появившихся линий определяется молекулярным строением вещества.
Спектроскопия комбинационного рассеяния света (или рамановская спектроскопия) — эффективный метод химического анализа, изучения состава и строения веществ.
ВОЗБУЖДЕНИЕ АТОМА И МОЛЕКУЛЫ
- квантовый переход атома или молекулы с более низкого (напр., основного) уровня энергии на более высокий при поглощении ими фотонов (фотовозбуждение) или при столкновениях с электронами и др. частицами
-Под действием света относительно слабой интенсивности
-При столкновениях с электронами и др. атомными частицами
74. Особенности поведения электрона в атоме водорода
Первая особенность. Энергия свободного электрона, так же как и энергия тела, может изменяться непрерывно, но энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения.
Вторая особенность. Электрон в одних случаях проявляет свойства частицы вещества, а в других – волновые свойства. Такая двойственность поведения электрона и других микрочастиц (дуализм) – одно из общих свойств материи (и вещества, и поля). Оно называется "корпускулярно-волновой дуализм" или "дуализм волна-частица ".
Третья особенность. Чем с большей точностью определяют положение электрона в пространстве, тем с меньшей точностью можно определить его скорость. И наоборот, чем с большей точностью определяют скорость электрона (абсолютную величину и направление), тем с меньшей точностью можно определить его положение в пространстве.
уравнения
Шрёдингера
для атома водорода. Так как потенциальная
функция электрона в атоме водорода
имеет вид
![]() где
e
— заряд электрона (и протона), r
— радиус-вектор,
то уравнение
Шрёдингера
запишется следующим образом:
где
e
— заряд электрона (и протона), r
— радиус-вектор,
то уравнение
Шрёдингера
запишется следующим образом:
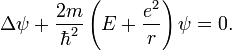
Здесь
ψ
— волновая
функция
электрона в системе отсчёта протона, m
— масса электрона,
![]() —
постоянная
Планка,
E
— полная энергия электрона,
—
постоянная
Планка,
E
— полная энергия электрона,
![]() —
оператор
Лапласа.
—
оператор
Лапласа.
Квантовые числа
Главное К. ч. n = 1, 2, 3,... определяет уровни энергии электрона.
Азимутальное
(или орбитальное) К. ч. l
=
0, 1, 2,..., n
—1
задаёт спектр возможных значений
квадрата орбитального момента количества
движения электрона:
![]() .
.
Магнитное
К. ч. ml
характеризует
возможные значения проекции Mlz
орбитального
момента Ml
на
некоторое, произвольно выбранное,
направление (принимаемое за ось z):
![]() ;
может принимать целые значения в
интервале от — l
до
+
l (всего
2
l + 1
значений).
;
может принимать целые значения в
интервале от — l
до
+
l (всего
2
l + 1
значений).
Магнитное спиновое К, ч., или просто спиновое К. ч., ms характеризует возможные значения проекции спина электрона и может принимать 2 значения:
ms = ± 1/2.
K-слой является первым от ядра атома, ему соответствует главное квантовое число n = 1, L-слой — вторым, M-слой — третьим и т. д. Электроны, образующие данный слой, могут обладать несколько отличающейся друг от друга энергией и иметь орбитали различных форм. Из квантовомеханической теории следует, что с увеличением главного квантового числа n изменяются число и характер электронных орбиталей в пределах данного электронного слоя. Количество орбиталей для каждого значения n равно квадрату главного квантового числа (n2). Второе квантовое число l, описывающее форму электронного облака, называется орбитальным квантовым числом. При данном главном вантовом числе n орбитальное квантовое число l может принимать любые целочисленные значения от 0 до n–1. Соответствующие орбитали обозначаются строчными буквами латинского алфавита: s (l = 0), p (l = 1), d (l = 2), f (l = 3). Орбитальное квантовое число отображает энергию электрона на подуровне. Электроны с различными орбитальными квантовыми числами несколько отличаются друг от друга: их энергия тем выше, чем больше число l. Число возможных подуровней в каждом энергетическом уровне совпадает с порядковым номером электронного слоя, но фактически ни один энергетический уровень не содержит больше четырёх подуровней. Это справедливо для стационарного состояния атомов всех элементов. Так, первому энергетическому уровню соответствует s-подуровень; второму уровню — два подуровня: s и p; третьему уровню — три подуровня: s, p и d; четвёртому и следующим уровням —четыре подуровня: s, p, d и f.
75.Введение в квантовую биофизику
Фотобиологические процессы
происходят в результате воздействия света на организм. Важнейшими Ф. п. у растений являются фотосинтез (синтез органических молекул за счет энергии солнечного света), фототаксис (движение организмов, например бактерий, к свету или от света), фототропизм (поворот листьев или стеблей растений к свету или от света), фотопериодизм (регуляция суточных и годовых циклов жизни путем циклических воздействий свет — темнота).
У человека и животных к Ф. п. относят Зрение, фотопериодизм и др.
Стадии фб процесса:
1. Поглощение света в биологических системах
2. Люминесценция в биологических системах
3. Первичные и начальные стадии фотопревращений биомолекул
4. Механизмы фотобиологических процессов при действии ультрафиолетового излучения
5. Фотофизические и фотохимические стадии зрения у позвоночных и фотосинтеза в галобактериях
Поглощение света, уменьшение интенсивности оптического излучения (света), проходящего через материальную среду, за счёт процессов его взаимодействия со средой. Световая энергия при П. с. переходит в различные формы внутренней энергии среды; она может быть полностью или частично переизлучена средой на частотах, отличных от частоты поглощённого излучения.
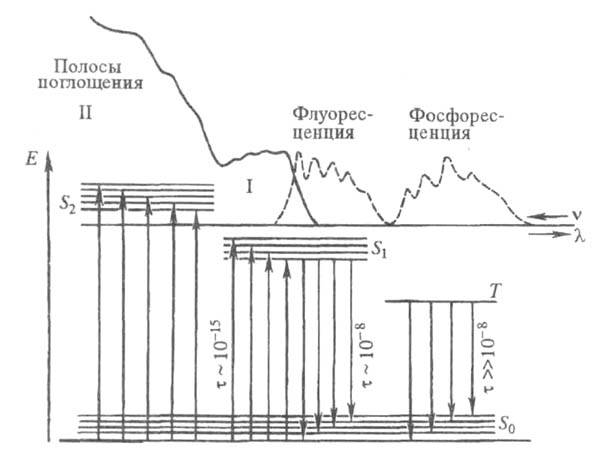
Спектральный анализ — совокупность методов качественного и количественного определения состава объекта, основанная на изучении спектров взаимодействия материи с излучением, включая спектры электромагнитного излучения, акустических волн, распределения по массам и энергиям элементарных частиц и др.
Атомный и молекулярный спектральный анализы позволяют определять элементный и молекулярный состав вещества, соответственно. В эмиссионном и абсорбционном методах состав определяется по спектрам испускания и поглощения. Что получило большое значение в фармации.
Пути растраты энергии:
1. Безизлучательный переход в основное состояние с обращением спина электрона.
2. Испускание кванта фосфоресценции.
3. Фотохимическая реакция.
4. Передача энергии возбуждения другой молекуле.
Люминесце́нция — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения.
Фотолюминесценция, люминесценция, возбуждаемая светом. Простейший случай Ф. – резонансное излучение атомных паров, когда испускается электромагнитное излучение такой же частоты, какую имеет возбуждающее излучение.
Флуоресце́нция
(вариант: флюоресценция)
— физический процесс, разновидность
люминесценции.
Флуоресценцией обычно называют
излучательный переход возбужденного
состояния с самого нижнего синглетного
колебательного уровня S1
в основное состояние S0.
В общем случае флуоресценцией называют
разрешенный
по спину
излучательный переход между двумя
состояниями одинаковой мультиплетности:
между синглетными уровнями
![]() или
триплетными
или
триплетными
![]() .
Типичное время
жизни
такого возбужденного состояния составляет
10−11−10−6
с.
.
Типичное время
жизни
такого возбужденного состояния составляет
10−11−10−6
с.
Стокса правило, Стокса закон, утверждает, что длина волны фотолюминесценции больше, чем длина волны возбуждающего света.
Миграция энергии, перенос энергии, самопроизвольный переход энергии с одной частицы — донора (атома или молекулы) на другую — акцептор. М. э. не связана ни с испусканием фотона донором и его поглощением акцептором, ни с обменом электронами или атомами между взаимодействующими частицами. М. э. — результат электромагнитного взаимодействия частиц (индуктивно-резонансный механизм) либо частичного перекрывания их электронных оболочек (обменно-резонансный механизм).
ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ, совокупность методов анализа, основанных на явлении люминесценции. Наиб. распространение получил анализ, основанный на фотолюминесценции исследуемого в-ва, возбуждаемой УФ излучением. Источниками последнего служат кварцевые газоразрядные ртутные или ксеноновые лампы и УФ лазеры. Pегистрируют люминесценцию визуально, фотографически или фотоэлектрически с помощью спектрографов, фотометров и спектрофотометров. Л. а. подразделяют на качественный и количественный. Качеств. Л. а. проводят по спектрам люминесценции.
