- •Методи визначення поверхневого натягу
- •Метод рахунку крапель
- •Метод капілярного підняття
- •Метод максимального тиску в газовому пухирці
- •Термодинаміка поверхневих явищ
- •Адсорбція
- •Термодинаміка адсорбції. Рівняння Гібса.
- •Рівняння Шишковського
- •3. Адсорбція на твердій поверхні
- •Адсорбенти. Класифікація
- •Природні Штучні
- •Вимоги до адсорбентів
- •Вплив різних факторів на величину адсорбції різних Адсорбентів
- •Теорія Ленгмюрa
Термодинаміка адсорбції. Рівняння Гібса.
Рівняння Гібса проводить паралель між надлишком адсорбованої речовини в поверхневому шарі Г, концентрацією ПАВ в розчині та поверхневим натягом .
![]()
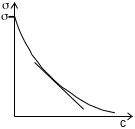
1.ПАР із зростанням с
зменшується
![]()
![]()
|
|
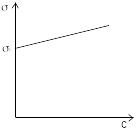
2.ПІАР із зростанням с
збільшується …![]() …
…![]()
|
|
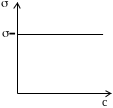
3.Речовини, які не впливають на поверхневий натяг
![]()
![]()
Величина
![]() характеризує адсорбційну здатність
речовин (здатність адсорбуватись в
поверхневому шарі).
характеризує адсорбційну здатність
речовин (здатність адсорбуватись в
поверхневому шарі).
Поверхнева активність![]()
Визначають як tg дотичної до кривої при даному значенні концентрації
![]()
Для кожної концентрації можна розрахувати
Г, і тоді ми будемо мати набір
![]() .Така
залежність називається ізотермою.
.Така
залежність називається ізотермою.
Формула
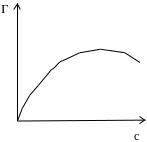
По мірі збільшення концентрації ПАР адсорбція зростає різко, а потім все повільніше проходить через максимум. Який має назву граничної адсорбції.
Існування
![]() досить легко можна пояснити, виходячи
з рівняння Ленгмюра.
досить легко можна пояснити, виходячи
з рівняння Ленгмюра.
ПАР у розчині орієнтовані Полярна група, яка має високу спорідненість до води (полярні фази) втягується в воду, в той час, як неполярний радикал, втягується в неполярну фазу.
При збільшенні вмісту ПАР утворюється мономолекулярний шар. При яких концентраціях молекули ПАР плавають на поверхні, це можливо завдяки гнучкості радикалу.
З ростом концентрації ПАР число молекул в поверхневому шарі збільшується, ланцюг припіднімається і приймає верхнє положення.
Частокол Ленгмюра пояснює той факт, що адсорбція зростає із збільшенням ланцюга в гомологічному ряду ПАВ, але для всіх членів ряду криві Г/С прагнуть до одного і того ж значення .
Малюнок
Насправді любий член ряду буде займати
однакове місце на поверхні рідини.
Довжина ланцюга не впливає на величину
граничної адсорбції. Тому маючи
можна
визначити, яку площу займає одна молекула
в поверхневому шарі якщо
![]() то
то![]() ,
показує, яку площу займає 1 кмоль
речовини при умові, що це не буде щільний
мономолекулярний шар, тоді площа, яку
займає одна молекула в поверхневому
шарі:
,
показує, яку площу займає 1 кмоль
речовини при умові, що це не буде щільний
мономолекулярний шар, тоді площа, яку
займає одна молекула в поверхневому
шарі:
![]()
Довжина молекули відповідає товщині шару
![]() об’єм одного шару молекул 1кмоль
об’єм одного шару молекул 1кмоль
![]() (
- густина речовини в чистому стані 1
молекула)
(
- густина речовини в чистому стані 1
молекула)
![]()
![]() довжина молекули
довжина молекули
Чим довший радикал, тим легше адсорбуються молекули або тим більша їх поверхнева активність.
Правило Траубе:
При продовженні вуглеводневого радикалу на одну групу CH2 поверхнева активність зростаэ в 3 – 3,5 рази.
Рівняння Шишковського
Характеризує зміну поверхневого натягу із зміною концентрації і є перехідним між рівняннями Гібса та Ленгмюра.
![]()
![]()
A - характеризує поверхневу активність речовини (велике позитивне значення), залежить від довжини радикалу, підкоряється правилу Траубе;
B - залежить від температури та від природи полярної групи
![]()
3. Адсорбція на твердій поверхні
До типових адсорбційних процесів відносяться:
очистка парів та газів;
виділення цінних домішок;
гетерогенний каталіз;
хроматографічний аналіз та розділення сумішей;
Адсорбція – зміна концентрації речовини на поверхні фази відносно її концент рації в об’ємі.