
- •Глава 7. Техническая вооруженность биотехнологических
- •Глава 8. Отходы биотехнологических производств,
- •Часть IV.
- •Глава 9. Микробиотехнология 374
- •Глава 10. Фитобиотехнология 489
- •Глава 11. Зообиотехнология 532
- •Часть I
- •Глава 1
- •Глава 2
- •Часть II.
- •Глава 3
- •Глава 4
- •I Iсвязанн
- •Глава 5.
- •Часть III.
- •Глава 6,
- •Декарбокси- лазы, редуктазы
- •Глава 7.
- •3600 15715 1* 900 1-2 (Диаметр рабочего колеса 960 мм) 4
- •7.2. Некоторые особенности культивирования биообъектов.
- •Глава 8.
- •Часть IV. Специальные биотехнологии
- •Глава 9.
- •9.3. Микробиотехнологические процессы
- •Глава 10.
- •Глава 11. .
- •Аминоптерин (4-аминофопиевая кислота)
9.3. Микробиотехнологические процессы
9.3.1. Получение продуктов брожения. Брожение — это одна из разновидностей биологического окисления субстрата у гетерот- рофных микробов в целях получения энергии, когда акцептором электронов или атомов водорода является органическое вещество. Биотехнологические бродильные процессы изучены давно в срав- нении, например, с биотехнологией антибиотиков, аминокислот и других продуктов. Однако некоторые брожения реализованы на практике относительно недавно, например, брожения с участием 2утотопаз зрр.
В основе многих бродильных процессов лежит универсальная реакция превращения глюкозы (источник углерода) в ключевой
392
промежуточный продукт (интермедиат) — пировиноградную кис- лоту, или пируват, из которого синтезируются различные конечные продукты. По метаболиту, образующемуся в наибольшем количе- стве, называют соответствующее брожение: спиртовое, масляно- кислое, молочнокислое, и т. д.
сн3сн2сн2соон![]()
сн3сосн3
т Ун
сн3сно ■
|сн3сосоон
СНэСН2ОН этанол
т
ацетон
КоА
соон
уксусная
кислота.
СН3(СН2)3ОН СН3СН2СООН
бупнол
9.3.1.1. Спиртовое брожение. Оно лежит в основе получения этилового спирта, кормовых и пищевых дрожжей, пивоварения и виноделия. Возбудителями спиртового брожения могут быть дрож- жи — сахаромицеты, некоторые мицелиальные грибы (АзрегдШиз огугае) и бактерии (Еплата ату1отога, Багета Vет.пси1а, Хутотопаз тоЪШз, 2. апаегоЫа). Среди названных организмов дрожжи зани- мают ведущее место, а получение с их помощью этанола относят к разряду наикрупнейших в мире. Этанол используют в различных отраслях народного хозяйства: то как растворитель, то как сырье для химического синтеза, широко используют в медицине, и т. д.
Специальные штаммы Засспаготусез сегелаыае рекомендованы как биообъекты в производстве этанола (на африканском конти- нете чаще применяют ЗсЫгозасспаготусез ротЬе и 5. ос1озрогиз). Штаммы подразделяют в свою очередь на расы верхового и низового брожений, а по способности к флокуляции — на хлопь- евидные и пылевидные. Расами верхового брожения являются спиртовые, хлебопекарные и некоторые пивные дрожжи, расами низового брожения — большинство винных и пивных дрожжей. Клетки обеих рас могут быть подвержены флокуляции. При этом следует помнить, что пылевидные дрожжи находятся в дисперги- рованном состоянии в течение бродильного процесса. Они менее стойки к автолизу, но более полно сбраживают сусло; хлопьевид- ные — оседают на дно или всплывают на поверхность, они более выраженные ароматизаторы.
Особенности некоторых продуцентов этанола приведены в таблице 41.
В отличие от 5. сегел^ае аэротолерантные бактерии 2. тоЬШз меньше чувствительны к этанолу, у них отсутствует катаболитная репрессия, а удельная скорость потребления глюкозы и образова- ния этанола в 2—3 раза выше (цС2Н5ОН= 1,87 г/г *ч). Катаболизм глюкозы протекает по Энтнеру-Дудорову. Однако скорость раз- множения этой бактерии низка и продуктивность по спирту не столь высока. Здесь остается резерв надежд на позитивные резуль- таты генетико-селекционной работы с продуцентом.
 Значительный
интерес представляет 5. говег.
Эти
дрожжи спо-
собны образовывать этанол
при использовании топинамбура (зем-
ляная
груша), в котором из углеводов содержится
преимуществен-
но инулин, сбраживаемый
после гидролиза до этанола. Топинамбур
хорошо
растет даже в северных регионах
(Архангельская, Ленин-
градская и
другие области) на бедных супесчаных
почвах.
Значительный
интерес представляет 5. говег.
Эти
дрожжи спо-
собны образовывать этанол
при использовании топинамбура (зем-
ляная
груша), в котором из углеводов содержится
преимуществен-
но инулин, сбраживаемый
после гидролиза до этанола. Топинамбур
хорошо
растет даже в северных регионах
(Архангельская, Ленин-
градская и
другие области) на бедных супесчаных
почвах.
 В
качестве сырья для производства этанола
в различных странах
используют
доступные растительные источники:
зерновые, карто-
фель и свекловичная
меласса — в России, Украине,
Беларуси;
сахарозу и тростниковую
мелассу — в США, рис — в Японии и т.
д.
В принципе любой источник гексозанов
может быть использован
в качестве
сырья для получения этилового спирта,
например,
целлюлоза в древесине
хвойных, соломе, торфе и пр. Поэтому
сульфитные
щелока — отходы целлюлозно-бумажной
промышлен-
ности нашли широкое
применение в производстве этилового
спир-
та.
В
качестве сырья для производства этанола
в различных странах
используют
доступные растительные источники:
зерновые, карто-
фель и свекловичная
меласса — в России, Украине,
Беларуси;
сахарозу и тростниковую
мелассу — в США, рис — в Японии и т.
д.
В принципе любой источник гексозанов
может быть использован
в качестве
сырья для получения этилового спирта,
например,
целлюлоза в древесине
хвойных, соломе, торфе и пр. Поэтому
сульфитные
щелока — отходы целлюлозно-бумажной
промышлен-
ности нашли широкое
применение в производстве этилового
спир-
та.
Ниже представлена технологическая схема получения этанола, из которой видно, что первым делом необходимо трансформиро- вать крахмал в глюкозу, чего добиваются при обработке сырья
395
амилолитическими ферментами. На практике обычно применяют грибную амилазу (АзрегдШиз тдег, А.огугае и др.) или пророщен- ное зерно (солод). Крахмал
Клейстеризация
+ ферменты солода (преимущественно ячменного) или грибов Осахаренная масса (затор) 4- + дрожжи Бражка 4- дистилляция Этанол
Крахмал для получения этилового спирта может быть различ- ного происхождения (картофельный, кукурузный, пшеничный, рисовый). Крахмалистое сырье предварительно дробят (измельча- ют), применяя для этого вальцовые, молотковые или другие дро- билки. Крахмал необходимо клейстеризовать при разваривании. Например, пшеница и пшеничная крупчатка способны полностью клейстеризоватъся при 68°С в течение 30 мин. Крахмал затем должен быть гидролизован до низших Сахаров (моноз, биоз), поскольку более высоко полимеризованные углеводы не сбражи- ваются дрожжевыми организмами. В качестве гидролизующих агентов применяют соответствующие ферментные препараты из нитчатых грибов или солода. Крахмал состоит из амилозы и амилопектина. Неразветвленная амилоза почти полностью гидро- лизуется до биозы — мальтозы, тогда как разветвленный амило- пектин гидролизуется лишь частично — до декстринов, медленно разлагаемых дрожжами до мальтозы в процессе брожения.
Кроме сахаров и декстринов в заторах обычно содержатся аминокислоты, пептиды, макро- и микроэлементы в виде неорга- нических солей (фосфор — еще и в виде фосфорорганических соединений).
Сбраживание затора .осуществляется с помощью чистых куль- тур либо периодическим, либо непрерывным способом. Относи- тельно высокие начальные концентрации сахаров и декстринов в заторах неблагоприятны для бактерий — контаминантов из-за повышенного осмотического давления. Позже, когда осмотическое давление снижается, образующийся этанол и естественно возра- стающая или искусственно создаваемая подкислением серной кислотой) кислотность среды (рН 3,8—4,0) выступают основными
396
факторами, предотвращающими развитие контаминирующих бак- терий.
В период брожения поддерживают темпрературу от 30°С до 38°С, (в зависимости от расы дрожжей).
На сбраживание затора влияют не только вид и раса дрожжей, температура и рН, но и конструктивные особенности фермента- ционных аппаратов (система охлаждения/нагрева, способ и интен- сивность перемешивания). Длительность сбраживания составляет в среднем от 1,5 до 3 суток.
В бражке накапливается от 1—1,5% до 6,5—8,5% этанола; его перегоняют и ректифицируют до 96%. Кроме того, в бражке содержатся так называемые "сивушные масла" (высококипящая фракция;— 90°—150°С) и 5—10% альдегидов с эфирами. Сивушные масла представляют собой смесь изопропилового и н-пропилового, изобутилового и н-бутилового, изоамиловых (2-метил- и 3-метил- бутанолы) спиртов. Доля последних двух обычно составляет 50%; в сивушных маслах находят также В -фенил- и р-оксифенилэтило- вые спирты.
Исходя из расчетов по содержанию крахмала на сухое веще- ство, различные сорта кукурузы, пшеницы, риса, сорго накапли- вают в среднем 65—75% крахмала, из которого можно получить до 45 дкл этанола.
Отходами производства являются барда и диоксид углерода. Барду используют для откорма скота и птиц, диоксид углерода — в пищевой промышленности, например, в виде "сухого льда".
Этанол можно получать также при сбраживании гидролизатов древесных и травянистых растений, содержащих целлюлозу. В таких гидролизатах обычно содержится 2—3,5% редуцирующих сахаров (преимущественно — гексозы и, меньше, пентозы, в большем количестве присутствующие в гидролизатах древесины
лиственных растений).
Применив методы генетической инженерии, удалось включить в дрожжи ЗсЫговасспаготусез ротЬе ген, кодирующий биосинтез фермента ксилозоизомеразы. Этот фермент катализирует реакцию превращения Б-ксилозы в Б-ксилулезу. Векторной системой при этом была "ксилозоизомеразная" плазмида ЕвсЬепсЫа соН.
Как известно, Б-ксилулоза может включаться в пентозный цикл, способный переключаться на гликолиз с помощью образую- щихся ключевых веществ — фруктозо-6-фосфата и 3-фосфогли- церинового альдегида (интермедиаты в пентозном цикле). В итоге удалось добиться прямой конверсии ксилозы в этанол. Следова- тельно, клетки 5.ротЬе, несущие ген ксилозоизомеразы, стали
способными одновременно сбраживать глюкозу и ксилозу в гид- ролизатах разных пород древесины.
Известны природные виды бактерий, сбраживающие глюкозу и ксилозу, например, ТпегтоапаегоЪас1ег еШапоНсиз. Однако не- обходимо иметь в виду рентабельность бактериальных анаэробных ферментации гидролизатов растительных отходов — она реальна лишь в тех случаях, когда концентрация этанола в бражке будет не ниже 4,5—5%.
Так называемый "гидролизный спирт" после ректификации содержит до 0,05—0,1% метанола и относительно повышенные количества альдегидов, органических кислот и эфиров в сравнении с этанолом — ректификатом из картофеля или зерен.
Отходами целлюлозного производства являются сульфитные щелока, содержащие около 3% редуцирующих веществ (таблица 42).
Т а б л и ц а 42. Примерный состав сульфитных щелоков
Ингредиенты |
% |
Сухие вещества |
11,5-12,2 |
Редуцирующие вещества в пересчете на глюкозу |
2,0-2,7 |
Сбраживаемые углеводы в пересчете на глюкозу |
1,3-1,9 |
Метоксильные группы |
0,78-0,8 |
Зола |
1,2-2,1 |
Диоксид серы |
0,4-1,4 |
Оксид кальция |
0,6-1,0 |
Общая сера |
0,9-1.6 |
Сульфаты |
0,1 |
Сахара в сульфитных щелоках, например, из ели, обычно включают глюкозу—около 29%, галактозу — 4,2%, маннозу — 43%, пентозы — 17%, уроновые кислоты — 3%, фруктозу — 4%.
Сорта и происхождение древесины, условия сульфитной варки сказываются на качественных и количественных показателях для сульфитных щелоков.
Из щелоков извлекают прежде всего целлюлозу, после гидро- лиза которой сбраживание гексоз (глюкозы) осуществляют с по- мощью специальных рас ЗассЬаготусез сегелаыае. "Сульфитный" спирт — один из наиболее дешевых, он содержит до 2—8% метанола, а также другие примеси. Его используют в технических целях.
Применяя древесину, обычно стремятся совместить получение этанола и дрожжей, хотя оба этих процесса можно вести по отдельности. Ниже приведена схема комбинированного использо- вания целлюлозы.
Гидро- лиз
Древесина
-50-,
пар -^|+ Н^Оз"*
Варка целлюлозы Сепарирование ^*Сульфитный щелок
Целлюлоза < Сепарирование
к пар
Продувание щелока
+ известковое молоко (аммиачная вода)
' > Нейтрализация
Осадок (отход) 4 ^
Осветленный раствор
Охлаждение Спиртовое брожение
пар
Дистилляция и ректификация
Этанол, метанол и пр. < ^
Охлаждение
аэрация >|т- питательные соли и
• Iдрожжи Флотация, промывание, сепариро- вание, высушивание
Кормовые дрожжи
Расчетами показано, что при совмещенном производстве спирта и кормовых дрожжей "выходные" показатели на 1 т абсолютно сухой древесины выглядят следующим образом: этанол (абс.) — 175—182 л, метанол — 2 кг, сивушные масла — 0,3 кг, фурфурол (94%-й) — 5,6 кг, диоксид углерода (жидкий) — 70 кг, дрожжи с остаточной влажностью 10% — 32 кг, лигнин (абсолютно сухой) — 380 кг, гипс — 225 кг.
На сульфитных щелоках можно получать грибную кормо- вую массу, используя, например, сапрофитный Раесйотусез Vапо1:^, который утилизирует гексозы, пентозы и ацетат. Подо- бная технология разработана в Финляндии.
При спиртовом брожении часто используют мелассу — отход производства свекловичного или тростникового сахара (патока). Она содержит в среднем 80% сухих веществ и 20% воды. Примерно от 30—40% до 45—50% сухих веществ состав- ляет биоза-сахароза, 0,5—2% — раффиноза и до 12—18% — инвертный сахар (смесь глюкозы и фруктозы), прочие вещества представлены аминокислотами, бетаином (органическое осно- вание), некоторыми витаминами группы В, неорганическими солями, пигментами; рН мелассы находится в диапазоне 7,2— 8,9.
Мелассу применяют одновременно для получения этанола и -кормовых дрожжей (Рис. 128а). Сравнивая "паточные" и "гидролизные" дрожжи, можно привести следующие данные по основным ингредиентам клеток (таблица 43).
В паточных дрожжах сравнительно меньше липидов, неко- торых витаминов (биотина, инозита, гшридоксина, рибофлави- на), углеводов, но несколько больше кислоты пантотеновой, тиамина, холина и зольных элементов; паточные и гидролизные дрожжи примерно одинаковы по содержанию белков и по коэффициенту отягощения белка азотом нуклеиновых кислот, или КОБА-коэффициенту, равному 20% (N„^/N00,,. • 100). Для сравнения можно указать на КОБА-коэффициент для белка нитчатых грибов — он равен 2—5%, что выгодно отличает его от белка дрожжей и, тем более, от белка бактерий (КОБА-ко- эффициент 30%).
Т а б л и ц а 43. Химический состав "паточных" (ПД) и "гидролизных" дрожжей (ГД), % от сухих веществ
Ингредиенты |
ПД |
гд |
Белки |
46—52 |
43—58 |
Биотин |
3-ИГ5—1,6 •ИГ* |
6 -Ю-5—2,3- 10"' |
Зольные элементы |
12—14 |
5—11 |
Инозит |
0,045—0,35 |
0,12—0,48 |
Кислота никотиновая |
0,036—0,045 |
0,04—0,06 |
Кислота пантотеновая |
0,009—0,011 |
0,006—0,01 |
Липиды |
0,5—2 |
3—4 |
Пиридоксин |
7-Ю"4—1,2-10 3 |
1-10"3—2-Ю3 1 |
Рибофлавин |
0,004—0,007 |
0,004—0,013 |
Углеводы |
10—18 |
11—23 |
Холин |
0,38—0,75 |
0,25—0,45 |
 Одна
из схем. получения этанола и хлебопекарных
дрожжей на
мелассе приведена на рис.
128(6). Перед перегонкой бражки
(позиция
7) хлебопекарные дрожжи сепарируют.
Барду в данном
производстве можно
использовать для выращивания
кормовых
дрожжей.
Одна
из схем. получения этанола и хлебопекарных
дрожжей на
мелассе приведена на рис.
128(6). Перед перегонкой бражки
(позиция
7) хлебопекарные дрожжи сепарируют.
Барду в данном
производстве можно
использовать для выращивания
кормовых
дрожжей.
Дрожжевые организмы, применяемые для получения этанола из патоки, должны быстро и эффективно сбраживать высокие концентрации сахаров (включая рафинозу) и быть устойчивыми к повышенной температуре (до 35°С).
Чтобы приготовить затор, патоку разбавляют водой до получе- ния 14—18%-й концентрации сахаров, подкисляют серной кисло- той (можно соляной или молочной) до рН 4—5, при необходимости добавляют 0,1% аммонийных и 0,01% фосфорных солей, а затем 2—4% по объему.суспензии активных дрожжей ЗассЬаготусез сегелов1ае [в России чаще используют расы У-30 (рис. 129), а также диплоидные гибриды 67 и 73, полученные в результате соматиче- ской гибридизации расы Я и пивных дрожжей, образующих а-галактозидазу].
 Брожение
ведут при темпе-
ратуре 21—27°С в начале
про-
цесса, при 32—33°С — в после-
дующее
время. Длительность
брожения зависит
от качества
мелассы, в среднем
продолжи-
тельность составляет 36—72
ча-
са, содержание этанола в браж-
ке
составляет 6—9%.
Брожение
ведут при темпе-
ратуре 21—27°С в начале
про-
цесса, при 32—33°С — в после-
дующее
время. Длительность
брожения зависит
от качества
мелассы, в среднем
продолжи-
тельность составляет 36—72
ча-
са, содержание этанола в браж-
ке
составляет 6—9%.
Бактериальная контамина- ция заторов, как правило, иск- лючена благодаря их низким значениям рН и высокому со- держанию сахаров (оба фактора являются основными, определяющими ингибирование роста бак- терий).
. Процесс брожения можно осуществлять в различных вариан- тах — непрерывном, двухстадийном. На рис. 128 показан двухста- дийный процесс, когда в дрожжегенераторах (позиция 6) среду аэрируют 3—4 м3/м3«ч при 28—30°С и рН 4,2—4,5; дрожжи наращивают до 2,5—6,5% на сухие вещества, затем передают в бродильные аппараты (позиции 8,9), где в анаэробных условиях протекает спиртовое брожение. Перегонку или дистилляцию спир- та проводят с целью его отделения от примесей и последующей ректификации до получения 96% этанола или абсолютного (100%) спирта.
Спиртовое брожение можно интенсифицировать различными путями:
использованием непрерывной ферментации вместо перио- дической, что повышает продуктивность системы по этанолу более чем в 2 раза; при этом желательно применение флокулирующих рас активных дрожжей, осуществление рециркуляции биомассы, иммобилизации клеток;
проведением вакуумной ферментации при разрежении 4265,6—4665,5 Па с целью удаления этанола и снижения его ингибирующего действия (не забывать при этом о возможной контаминации);
осуществлением флеш-ферментации," то есть, когда часть культуральной жидкости периодически подают в вакуумную ка- меру для удаления этанола;
благодаря селекции этанол-толерантных штаммов микроор- ганизмов, способных в ходе брожения образовывать сравнительно высокие концентрации спирта.
В различных странах мира названные пути интенсификации спиртового брожения уже применяют на практике.
В последние годы реализованы усилия исследователей по не- прерывному бессепарационному сбраживанию углеводсодержаще- го сырья с использованием дрожжей, иммобилизованных на по- верхности раздела фаз "газ-жидкость", то есть на пузырьках газа. С этой целью используют определенные Штаммы дрожжей, напри- мер, СапсНёа ггоргсапв, выращиваемых в анаэробных условиях.
Коэффициент иммобилизации (Кш) рассчитывают по формуле
Ки„ = ——— , где XI — концентрация в биореакторе абсолютно
сухих дрожжей в г/л, х2 — концентрация таких же дрожжей (г/л) в оттоке. Для различных дрожжевых организмов Кщ, неравнозна- чен. Для БассЪаготусез сегещБ1ае и 5.иуашт он равен 0,1; для Блат — 0,22, для БсЫговассЬаготусев эр. штамм ЛГС-1 — 0,07; для С.ггор1сап8 — от 0,62 до 1,0.
Основные условия реализации данного процесса: способность клеток к флотации, работа ферментатора в режиме газожидкост- ной эмульсии, осуществление отбора культуральной жидкости в зоне, лишенной подвода энергии на перемешивание.
Приемлемый газо-эмульсионный режим возникает при интен- сивном барботаже пенящихся субстратов. Для этой цели пригодны ферментаторы с ярусными турбинными мешалками (рис. 130):
403

Описанный способ имеет следующие преимущества: отсутст- вие диффузионного барьера между клетками и средой культиви- рования, прочная адгезия клеток, нет необходимости регенериро- вать носитель, возможность проведения процессов накопления клеток, их иммобилизации и осуществление основного биотехно- логического процесса получения спирта на одном и том же обору- довании.
На примере спиртового брожения показано, что выход этанола составляет 95% от используемого сахара.
Целенаправленное получение хлебопекарных дрожжей (расы верхового брожения) реализуют на мелассной среде при аэрации (рН 4,4—4,5) по так называемому приточному методу, когда среду подают в биореактор преимущественно непрерывным, умеренно возрастающим (по объему) потоком. На первом и последнем часе ферментации аэрация равна 1:1, в период интенсивного размно- жения дрожжей — 1,5—2 об/об «мин. Клетки при этом проходят все фазы размножения. Выход прессованных дрожжей составляет около 38% сухой, биомассы (порядка 150% от использованного сахара).
Отсепарированные, промытые водой и спрессованные хлебо- пекарные дрожжи хранят при 4—5°С в рефрижераторах. Требо- вания к таким дрожжам следующие: влажность не более 75%, быстрая реактивация в замесах муки, активное сбраживание Са- харов (высокие подъемная сила и мальтазная активность), солето- лерантность и устойчивость к примесям в мелассе.
Изготавливают также сухие хлебопекарные дрожжи, высуши- вая прессованные до влажности 7—10%, и так называемые "жидкие дрожжи", представляющие собой полуфабрикат, содержащий хле-
бопекарные дрожжи, выращенные на осахаренной мучной завар- ке, которая предварительно была заквашена молочнокислыми бактериями — 1лс1оЪасШи8 ЫеШгиескп.
Спиртовое брожение находится также в основе пивоварения. Пиво относят к так называемым солодовым слабо алкогольным напиткам, получаемым в результате сбраживания дрожжами экс- трактов из проросших семян хлебных злаков (солода). В подобных экстрактах содержатся сбраживаемые углеводы.
В различных сортах пива находятся этанол, углеводы (глюкоза, мальтоза, мальтотриаоза, мальтотетраоза, декстрины), азотистые вещества (амиды, аминокислоты, пептоны), диоксид углерода '— продукты ферментативного гидролиза осоложенного зерна; горе- чи, смолы, танин, эфирные масла — из соцветий женских особей хмеля, следы неорганических солей и жира. Окраска, аромат и крепость пива в значительной степени зависят от штамма дрожжей (Басспаготусез сегела81ае, 5. сагкЪегдепв^в и др.). В России наиболее широко используют 5. сегелав^ае низового брожения, расы 776, 41, 44, 11, 8а(М), Р и Р.
На практике чаще всего применяют ячменный солод. Для его приготовления отсортированные зерна ячменя увлажняют, прора- щивают при 15—25°С до тех пор, пока зародышевый листок становится в 3—4 раза длиннее зерна, затем проросший ячмень высушивают до конечной влажности солода 5%. В таком виде солод может хорошо сохраняться, при этом он имеет специфические окраску и аромат. Солод светлого цвета получается при более низкой температуре высушивания, более темного цвета — при повышенной температуре (светлые сорта пива содержат меньше углеводов, чем темные сорта). Отделенный от проростков сухой солод может быть использован не только в пивоварении, но и в винокурении (получении спирта), в кондитерском производстве.
Если пиво изготавливают из солода, хмеля и воды (без каких- либо "дополнителей"), то следующим этапом является затирание, когда стремятся перевести в раствор наибольшую часть содержи- мого солода. Затирание чаще осуществляют либо настаиванием, либо вывариванием. По первому методу солод дробят, размешива- ют в воде при температуре 38—50°С (выдерживают 1 час), когда активизируются протеазы, затем температуру повышают до 65— 70°С и оставляют затор на несколько минут для гидролиза крахмала. После этого температуру повышают до 75—77°С для денатурации ферментов и затор фильтруют.
405
По второму методу (вываривание) размолотый солод вносят в теплую (40 С) воду, размешивают и постепенно повышают темпе- ратуру затора до 75°С; около 1/3 такого затора отбирают и непро- должительно кипятят, после чего его возвращают в основной затор. При этом ферменты разрушаются, клеточные стенки набухают, крахмал "распускается" (разжижается), чем облегчается его гидро- лиз в основном заторе. Кипячение и возврат части затора можно повторять 2—3 раза.
Пиво, полученное на настоенном заторе, более ароматное, поскольку в него переходит меньше горьких веществ.
Последующие этапы технологического процесса пивоварения заключаются в следующем:
Затор
фильтрация
Дробина <- (отход)
Осадок <-
(альбумины, Хмелевы смопы, неорганические соли)
Осадок <-
(клетки дрожжей,
нерастворимые
фосфаты)
-у Сусло неохмеленное
кипячение + хмель
— Фильтрация
^ охлаждение
Сусло охмеленное
^ + дрожжи Сусло сброженное (пиво неосветленное)
выдержка в лагер- ных емкостях в течение нескольких недель . Пиво осветленное
^ фильтрация
Пиво на розлив (пастеризация)
Пивные дрожжи относят к разряду флокулирующих, оседаю- щих при осветлении молодого пива и в конце дображивания; они не сбраживают декстрины (эти полимерные углеводы вносят оп- ределенный вклад в создание вкуса пива). Отсепарированные пивные дрожжи иногда рекомендуют в качестве лекарственного средства.
В последние годы удалось перенести ген Вас.виЪгШв, детерми- нирующий В-глюканазу в пивные дрожжи З.сегелпыае. Этот реком-
406
бинантный штамм оказался способным перерабатывать крахмал непосредственно в этанол (исключается стадия солодования ячме- ня). В этом направлении также перспективно использование бро- дильных штаммов дрожжей 5.сегеУ181ае, несущих киллер-плазми- ды, благодаря которым они могут быть устойчивы к "диким" дрожжам.
Из алкогольных напитков можно упомянуть русский хлебный квас, содержащий менее 0,5% этанола, популярный в Японии алкогольный продукт Саке (12—24% этанола), таэте — алкогольный напиток, приготовляемый из молока и с давних пор применяемый в Скандинавских странах — содержит менее 2% этанола, и другие.
Спиртовое брожение находится также в основе виноделия. Вина обычно получают из сока спелого неиспорченного винограда, отделенного или неотделенного от мезги (например, при изготов- лении красных вин). Индукторами брожения являются различные расы Засспаготусев сегелдв^ае. В винах, кроме этанола, содержатся: белки, пигменты, неорганические соли, летучие и нелетучие орга- нические кислоты, танин, в некоторых сортах — углеводы, глице- рин.
Изготовление вин отрабатывалось веками, поэтому в техноло- гии каждого сорта существуют особые подходы, хотя принципи- альные стадии укладываются в следующую схему:
Отстой <— (дрожжи)
Виноградный сок, или сусло
+ дрожжи (температура брожения 21-32,2°С)
Молодое вино слив
Осадок <
[КС4Н5Ой (винный камень), дрожжи]
Дображивание 7-11 дней, т°=21,1-29,4°С
переливание
Хранение и созревание в деревянных герметичных сборниках
осветление (при необходимости - крепление виноградным спиртом), охлаждение
Готовое вино, розлив
Вина классифицируют по-разному. Так различают: сортовые
по сорту винограда, купажные — из смеси сортов; сладкие и сухие — по содержанию сахара; натуральные и крепленые, столо- вые и десертные — по содержанию спирта; игристые и неигристые
по содержанию углекислоты; белые и красные — по цвету; ординарные и марочные — по срокам выдержки.
Как пояснение к классификации можно отметить, что в сухом вине сахар фактически полностью сброжен, а если он имеется, то в таком количестве, что не ощущается на вкус. В сладких винах сахар выраженно ощущается на вкус. Натуральные вина содержат, как правило, 9—11% этанола, реже — 13%. В крепленые сухие вина добавляют коньяк или винный спирт. Столовые вина содержат менее 14% спирта, десертные — более 14% (в среднем около 20%) и некоторое количество сахара. Игристые вина содержат значи- тельное количество диоксида углерода, образующегося при добра- живании вина в толстостенных сосудах или добавляемого к нату- ральным винам; к игристым относят шампанское — продукт вторичного брожения вина, когда к недобродившему вину перед розливом в герметизированные бутылки добавляют ликер до со- держания сахара 2,2%. В России разработана технология производ- ства шампанского непрерывным методом. В шампанском содер- жится не только повышенное количество углекислоты, но и ряд ценных метаболитов, сказывающихся на специфическом вкусе этого вина.
Вина, выпускаемые в продажу на первом году после изготов- ления, называют ординарными, а выдержанные не менее 1,5 лет и сохраняющие свои высокие качества — марочными.
Известны так называемые плодовые вина (кроме виноградных), получаемых при спиртовом брожении соков зрелых плодов: ягод- ное, яблочное и др.
На виноградных ягодах поселяются различные микроорганиз- мы (дрожжи, нитчатые грибы, бактерии), которые необходимо подавить, так как в противном случае будет трудно гарантировать получение вина высокого качества. Как ингибитор микробов — контаминантов давно и эффективно используют сернистый газ или сульфит, например, в виде метабисульфита калия (примерно от 0,1 до 0,2% 502), не подавляющих производственный штамм дрожжей в его активную фазу. Пастеризация здесь оказывается менее благоприятной.
Концентрация сахара в винограде — важный фактор для ферментации (концентрация его в сусле выше 28% будет тормозить
408
брожение). Определенную роль играют исходное значение рН и температура. Чтобы избежать повышенной кислотности готового вина, было предложено устанавливать рН сусла ниже 3,6; опти- мальная температура для большинства рас дрожжей 27—29°С, но есть и психрофильные виды, сбраживающие виноградное сусло при 10°С. При низкой температуре и медленном брожении фор- мируется более яркий букет вина, чем при кратковременном брожении и повышенной температуре.
Аэрирование сусла возможно и целесообразно в самом начале процесса, чтобы быстрее наросла биомасса клеток для ведения последующего анаэробного процесса. Количество привносимой в сусло суспензии дрожжей обычно составлет 1% по объему.
В случае применения биореакторов больших емкостей для производства столовых вин бродящий сок принудительно охлаж- дают, используя теплообменники, змеевики или другие устройства.
Мезга (оболочки виноградных ягод, семена, частички стеблей и т. п.) привносит определенные сложности в связи с теплообменом при брожении — образование "шапки".
Очистка вин при естественном хранении и созревании не всегда завершается его полным осветлением. В этих случаях при- бегаются к очистке путем осветления, старения и созревания до розлива в бутылки. Дополнением к осветлению являются фильт- рация (в том числе — стерилизующая), пастеризация, охлаждение — для удаления винного камня и коллоидов.
9.3.1.2. Ацетонобуталовое брожение. Ранее упоминаемые угле- водные источники (крахмал, патока, гидролизаты целлюлозы раз- личного происхождения и др.), применяемые для дрожжей при спиртовом брожении, могут быть использованы при ацетонобути- ловом брожении, протекающем в анаэробных условиях в процессе жизнедеятельности спорообразующих бактерий — С1о8ТлЛшт асе1оЪи1уЦсит. В результате образуются такие нейтральные про- дукты, как ацетон и бутанол, а также уксусная и масляные кислоты, диоксид углерода, водород. Нейтральные продукты представляют большой интерес для промышленного органического синтеза (эфи- ров для лакокрасочной промышленности), как экстрагенты и рас- творители, и т. д. Несмотря на то, что синтетические и биотехно- логические процессы получения ацетона и бутанола являются конкурирующими, на практике реализуют оба вида производств, так как все зависит, главным образом, от стоимости сырья (эконо- мические проблемы). Очевидно "сосуществование" синтетических
409
и биологических технологий получения одних и тех же продуктов оправдано временем и жизнью общества.
с6вко6—►-С^СОСООН
■
МЫ » Адоффг - СНдСООН
(уЕг)гС00Н-« БярйЬА
уюуоиш пит
сн.
-I - кцямт »СН3С0СН3
т/т
I
СН3(СНг)гСН;0Н
Известно, что первичные алифатические спирты обладают антимикробным действием, поэтому в питательных средах концен- трация сбраживаемых углеводов не должна превышать 6%, так как С1. асе1оЬи1уИсшп не будет их утилизировать, если концентрация бутанола приближается к ингибирующей — 1,5%.
Сырьем для производства целевых продуктов обычно является меласса или сульфитные щелока, смешиваемые с кукурузным и ржаным мучным затором. Инокулят готовят из свежих спор (тем- пература выращивания 37°С), активных по образованию бутанола, на такой же среде. Основные ферментации проводят в периоди- ческом, полунепрерывном и непрерывном режимах. Исходное значение рН среды примерно 6,0. Уже через 12 часов рН снижается до 4,1—4,2 и на этом уровне остается до конца ферментации.
После окончания процесса сепарируют ацетонобутиловую бар- ду, а дистиллят упаривают, примерно наполовину и ацетон отде- ляют от этанола и бутанола перегонкой при различных темпера-
410
турах — ацетон кипит при 56,2°С, этанол — при 78,4°С, азеотроп бутанола с водой — при 93,4°С, чистый бутанол — при 117,7°С.
Отходами производства являются газообразные водород и ди- оксид углерода (порядка 30 м3 на 100 кг сахарозы, из которых около 70% составляет С02) и плотная ацетонобутиловая барда. Газы можно улавливать и применять для синтеза аммиака и метанола, или применять как таковые. Барда—ценный продукт, содержащий заметные количества рибофлавина; сухие вещества (преимущест- венно — азотистые) в ней составляют 3—5%. Ранее барду самосто- ятельно использовали в высушенном виде для кормления скота, в настоящее время ее применяют для выращивания кормовых дрож- жей.
9.3.2. Получение органических кислот. Прежде чем рассмот- реть конкретные биотехнологические процессы получения орга- нических кислот, необходимо оговориться, что под рубрику "бро- жения" должно быть отнесено образование в анаэробных условиях только молочной и пропионовой кислот с помощью соответствую- щих бактерий, тогда как биосинтез лимонной, глюконовой, итако- новой и некоторых других органических кислот определенными микромицетами представляет собой разновидность того или иного окислительного (аэробного) процесса и поэтому отнесение их к брожениям является условным.
9.3.2.1. Бродильные процессы получения органических кислот. Получение молочной кислоты. Образование молочной кислоты (СН3СНОНСООН) лактобактриями происходит в естественных условиях при скисании молока и молочных продуктов, а также при ее целенаправленном получении в производственных условиях. Молочнокислые бактерии относят к 4 родам: 1лс1оЪасШи8, Ьеисопоз1ос, 51гер1ососси8 и РесУсоссив. Род 1лс1оЬасШиз включает 3 подрода — ТпеппоЪасЪепшп, 51гер1оЪас1епит и Ве1аЪас1епшп. Представители первого из них не растут при 15°С, но могут выдерживать температуры выше 50°С. Стрептобактерии не явля- ются термофилами. Бетабактерии образуют БЬ-молочную кислоту из глюкозы. Одни из них (термобактерии, стрептобактерии, стреп- тококки и педикокки) являются гомоферментативными, образую- щими при сбраживании гексоз преимущественно молочную кис- лоту, другие (бетабактерии и лейконостоки) — гетерофермента- тивными, образующими молочную и уксусную кислоты, диоксид углерода, возможно — этанол; молочнокислые бактерии могут использовать мальтозу, глюкозу, лактозу, осахаренный крахмал и пр. В целом, лактобактерии — требовательны к питательным
411
средам — многие из них нуждаются в ряде витаминов из группы В, некоторых аминокислотах, пуринах и пиримидинах, отдельных органических кислотах алифатического ряда (уксусной, лимонной, олеиновой). Для сбраживания глюкозы и гидролизатов крахмала на практике применяют обычно 1лс1оЪасШи8 ёеНэгиескн, Ь. Ьи1дапси8, Ь. Шептали (одни или в смеси между собой или со 51гер1ососси81аси8), для сбраживания мальтозы иногда используют I.. саве1.
В промышленном производстве молочной кислоты обычно используют термофильные гомоферментативные виды, активно синтезирующие целевой продукт, например, при 50°С. Таким видом яляется Ъ. ёе1Ъгиескп штамм Л-3, отличающийся высокими стабильностью и активностью кислотообразования (выход молоч- ной кислоты составляет 95—98% от потребленной сахарозы). Этот вид внедрен в промышленность еще в 1923 г. под руководством В. Н. Шапошникова.
Принципиальная технологическая схема получения Ц + ) -мо- лочной кислоты состоит в следующем: мелассную среду, содержа- щую 5—20% сахара, вытяжку солодовых ростков, дрожжевой экстракт, витамины, аммония фосфат, засевают Ь йе1ЪгиескИ. Брожение протекает при 49—50°С при исходном рН 6,3—6,5. По мере образования молочной кислоты ее периодически нейтрали- зуют мелом. Весь цикл ферментации завершается за 5—10 дней; при этом в культуральной жидкости содержатся 11—14% лактата кальция и 0,1—0,5% сахарозы (80—90 г лактата образуются из 100 г сахарозы). Клетки бактерий и мел отделяют фильтрованием (отход), фильтрат упаривают до концентрации 30%, охлаждают до 25°С и подают на кристаллизацию, которая длится 1,5—2 суток. Кристаллы лактата кальция обрабатывают серной кислотой при 60—70°С, гипс выпадает в осадок, а к надосадочной жидкости добавляют желтую кровяную соль при 65°С для удаления ионов железа, затем натрия сульфат для освобождения от тяжелых металлов. Красящие вещества удаляют с помощью активирован- ного угля. После этого раствор молочной кислоты подвергают вакуум-упариванию (при остаточном давлении 800—920 кПа) до 50% или 80%. Оставшийся не до конца очищенный раствор молоч- ной кислоты используют для технических целей. Более очищенную кислоту можно получать при перегонке ее сложных метиловых эфиров, при экстракции простым изопропиловым эфиром в про- тивоточных насадочных колоннах.
412
С помощью ЪШдапсив получают молочную кислоту из мо- лочной сыворотки; гидролизаты пентозанов в кукурузных коче- рыжках, соломе и других видах пентозного сырья можно исполь- зовать для сбраживания клетками I*. Ъгелов.
В конце 80-х годов разработана технология получения молочной кислоты с помощью клеток 5ггер1ососси5 гпегторЫшз, адгезиро- ванными на микросферах из активированного угля и помещенны- ми в биореактор, работающий по принципу "кипящего" или псев- доожиженного слоя, через который перемещаются микросферы. В нижней части они сорбируют субстрат, в верхней — молочную кислоту, благодаря чему нет надобности в регуляции рН в процессе ферментации. Продуктивность системы — 12 г/л*ч"1 молочной кислоты.
Необходимо помнить о том, что молочная кислота является выраженным коррозирующим агентом. В то же время она быстро полимеризуется, а большинство ее солей хорошо растворимо в воде, благодаря чему молочную кислоту широко используют в пищевой," текстильной и фармацевтической промышленности, в изготовлении растворителей и пластификаторов в лаках, олифах и т. п.
Гомо- и гетероферментативные молочнокислые бактерии давно используются в хлебопечении. Их ассоциации с дрожжами, благо- приятные для создания аромата, вкуса, пористости, окраски и свежести, называют заквасками.
В России, особенно — в сельской местности, где хлеба выпе- кают в домашних условиях, закваски поддерживаются длительное время более или менее стабильными. Это обусловлено антагони- стическим влиянием лактобактерий на гнилостные, уксуснокислые и маслянокислые бактерии, энтеробактерий и др., но не на дрожжи, содержащиеся в заквасках. Тем не менее, специально приготов- ленные закваски из чистых культур предпочтительнее спонтанных (не контролируемых) ассоциаций, так как первые предсказуемы в своем "поведении" и легче управляемы.
Молочнокислое брожение находится в основе силосования кормов и квашения овощей (капусты, огурцов), плодов, ягод (маслин, яблок) и т. д. Эти процессы протекают за счет естественных микроорганизмов, находящихся на заквашиваемом объекте. В последнее время используют специальные закваски, обеспечива- ющие проведение процессов в прогнозируемых режимах и с ожидаемыми результатами.
Молочнокислыми продуктами являются различные сыры, пол- учаемые из обезжиренного или цельного молока. Такое молоко под влиянием лактобактерий и молочной кислоты створаживается — творог отделяют от сыворотки и засевают специальными мик- роорганизмами (в соответствии с сортом изготавливаемого сыра) с последующим выдерживанием его от нескольких недель до 8 месяцев (например, сыр "Чеддер") Для созревания.
Створаживание молока проводят также с помощью реннина — сычужного фермента из желудка (сычуга) молодых телят, или реннина микробного происхождения.
Молочнокислые бактерии включают в разные композиции профилактических и лечебных препаратов: бифидумбактерин, би- фикол, колибактерин, лактобактерин. Первый из них состоит из живых высушенных бифидобактерий определенного штамма, вто- рой — из живых бифидобактерий (штамм 1) и кишечной палочки (штамм М-17), третий содержит живые кишечные палочки штамма М-17, четвертый представляет собой сочетание лиофильно высу- шенных лактобацилл (Ь.^егтепй и Ьр1ап1агит).
За рубежом изготавливают так называемый пробиотик "Фер- лак-5", содержащий молочнокислые бактерии с добавками вита- минов А, Бз и Е. Его смешивают с кормом из расчета 1 млн. клеток бактерий на 1 г корма. Этот пробиотик рекомендуют поросятам, телятам и птицам.
Получение пропионовой кислоты. Пропионовокислое броже- ние характерно для пропионовых бактерий, культивируемых в средах, где глюкоза является источником углерода. Из трех молекул глюкозы образуется 4 молекулы пропионовой кислоты, 2 молекулы уксусной кислоты, 2 молекулы диоксида углерода и 2 молекулы воды:
ЗС6Н1206 —> 4СНзСН2СООН + 2СН3СООН + 2С02 + 2Н20. Фактически механизм образования пропионовой кислоты значи- тельно сложнее; ключевыми интермедиатами здесь являются пи- руват, метил-малонил-КоА, пропионил-КоА, сукцинил-КоА, окса- лоацетат.
Пропионовые бактерии представляют собой грамположитель- ные, бесспоровые, неподвижные палочки, подразделямые на "кож- ные" (Р.аспев, Р.аV^С1ит, Р.дгапи1овит) и "классические" (Р.1геийепге1сгш, Р.Шоегш, Р^епвегш, Р.аасИргорюта) в едином семействе РгорюгпЪас1епасае. "Кожные" обитают на кожных по- кровах человека и в желудке жвачных животных — они могут
414
быть причиной определенных патологических процессов (опти- мальная температура для их роста 37°С); "классические" пропио- новые бактерии обитают, как правило, в молоке и молочных продуктах. Температурный оптимум для них 37°С, анаэробы, но образуют каталазу, пероксидазу и супероксиддисмутазу (СОД), фиксируют С02, некоторые виды фиксируют молекулярный азот, утилизируют элементарную серу, нуждаются в витаминах группы В — биотине, пантотенате и тиамине.
При контакте с 02 у пропионовых бактерий образуются супер- оксидные радикалы, превращающиеся благодаря СОД в пероксид водорода, а этот последний разлагается под действием каталазы и пероксидазы.
Перспективными для производства пропионовой кислоты ока- зались виды Р.&еийептспп и Р.ас1сИргоргошс1, а для получения витамина В,2 — Р.&еиёепге1спц и Р.аспе!
Биосинтез кислоты проводят на достаточно простых средах, например, такого состава (в %): углевод — 1—2; аммония сульфат
0,3; гидрофосфат калия — 0,2; кобальта хлорид — 0,0001; бйотин
0,00001; пантотенат — 0,1; тиамин — 0,01.
Заметный прогресс наблюдается в совершенствовании процес- сов биосинтеза пропионовой кислоты иммобилизованными клет- ками в фиксированном слое, например, в ПААГ в колоннах. Так, в случае с Р.ас1саргорюшс1 при V = 0,05 ч 1 удается получать до 15 г/л целевого продукта.
Биосинтетическая пропионовая кислота может конкурировать с пропионатом "нефтяного происхождения", особенно в случае ее применения в пищевой и фармацевтической промышленности в качестве консерванта.
Конечные продукты ферментации (пропионат и ацетат) можно не разделять, поскольку обе кислоты обладают консервирующими свойствами. Клетки, отсепарированные от культуральной жидко- сти, могут быть экстрагированы соответствующими растворителя- ми в целях извлечения СОД, каталазы, пероксидазы и витамина В,2, высушенный экстракт в виде порошка используют в пищевой промышленности как антиоксидант и витаминизированный пре- парат.
9.3.2.2.0кислительные процессы. Получение уксуса. Известны различные виды и подвиды уксуснокислых бактерий, включенных в роды Асе1оЪас1ег и СшсопоЪас1ег. Форма их непостоянна (пол- иморфизм) —от эллиптических до палочковидных, молодые клетки не окрашиваются по Граму (грамотрицательны). Одни из них
415
подвижны — имеют жгутики, другие неподвижны. Ацетобактерии окисляют этанол в уксусную кислоту по схеме:
С2Н5ОН + 1/202 —» СНзСОН + Н20
СНзСОН + 1/202 —> СНзСООН
Некоторые штаммы могут содержать порфирины (биомасса клеток приобретает розовую окраску) или продуцируют водораст- воримый коричневый пигмент. Большинство ацетобактерии обхо- дится без витаминов в питательных средах. В естественных у слових их находят на овощах, фруктах и скисших фруктовых соках, в уксусе и в некоторых слабоалкогольных напитках. Типовой вид —Асе1оЪас1ег асеи.
Уксус (4—9%-й) непосредственно используют как приправу к различным блюдам, а также при изготовлении майонеза, горчицы, маринадов, соусов, хрена. Поэтому уксус, ранее получаемый из сахарных и фруктовых сиропов, вин, ягод и других аналогичных продуктов, предварительно сбраживаемых дрожжами до этанола, отличается высокими вкусовыми качествами. Однако в настоящее время основное количество уксусной кислоты получают синтезом ее из ацетилена:
СН=СН + ИОН-—у СВ^СНОН > СНзСОН ±^^>сн3соон
или выделением из продуктов сухой перегонки древесины (свя- зывание известью с последующим разложением серной кислотой до уксусной кислоты и гипса)? полученная таким способом кислота называется "ледяной" (77—80%-й концентрации). Разбавляя "ледя- ную" уксусную кислоту, в 10—20 раз, можно получить близкий к столовому уксус. Качество уксуса не изменяется и в случае при- готовления его из чистого эталона. В то же время уксус, полученный из фруктовых сиропов, вин, ягод и т. п., способен созревать, улучшая свои потребительские качества при хранении (прежде всего — за счет образования эфиров уксусной кислоты).
Поскольку уксуснокислые бактерии не превращают углеводы непосредственно в уксусную кислоту, постольку исходное сырье должно подвергаться спиртовому брожению (рис. 131). Самой старой технологией получения столового уксуса лучшего качества был так называемый медленный, или орлеанский (французский) процесс, в котором исходным сырьем было легкое виноградное вино, которым на 3/5 заполняли плоские деревянные чаны и туда же наливали столовый уксус, заполняя оставшиеся 2/5 объема (в
416
уксусе содержатся уксуснокислые бактерии). На поверхности смеси развивалась пленка ацётобактерий.
(+
Сепарирование - (уксусная смесь)
- Осадок дрожжевых клеток (отход)
Получение уксуса по орлеанскому (французскому), или медленному способу
Получение уксуса по немецкому, или быстрому способу
Рис. 131. Технологическая схема получения уксуса из различного сырья.
После завершения окисления этанола отбирали из чана 10% жидкости, а взамен добавляли столько же вина. Вместо плоских чанов можно использовать деревянные бочки, например, дубовые, емкостью до 20 дкл. В них должны быть отверстия для поступления воздуха и сливной кран. Процесс можно вести полунепрерывно, отрегулировав подачу свежих порций вина и слив готового уксуса.
В настоящее время почти везде "пищевой" уксус получают согласно так называемому "генераторному", или немецкому (быс- трому) процессу, впервы&^реализованному в 1832 г. Особенность его — создание максимальной поверхности для снабжения возду-
14 т. 8524
417
хом уксуснокислых бактерий и, как следствие, быстрое окисление спирта в уксусную кислоту. Названную технологию осуществляют так же в деревянных емкостях — трехсекционных генераторах (из дуба, пихты, красного дерева и пр.) В верхней секции размещено распылительное устройство для разбрызгивания 3—10% водного раствора этанола (например, сегнерово колесо), в средней — наполнитель для создания хорошо аэрируемой поверхности (стружки — буковые, березовые; стержни кукурузных початков; виноградные выжимки; керамические материалы и др.), в нижней — собирается готовый уксус. Секции в генераторах разделены дырчатыми перегородками. Воздух подается снизу и выходит через негерметично закрытый верх.
Генераторы могут быть рецеркуляционного типа на 30—60 м3, в которых воздух перекачивается с относительно постоянной скоростью и регулирование температуры (27—29°С) осуществляют путем охлаждения уксусной смеси.
При получении уксуса необходимо хорошо контролировать температуру и подачу воздуха, чтобы избежать заметной потери спирта и уксусной кислоты за счет их сгорания (полного окисления) до С02 и Н20. Питательные вещества (кроме спирта) в уксусной смеси будут влиять на жизнеспособность ацетобактерии.
Необходимо иметь в виду, что качество используемой воды для разбавления этанола могут заметно сказываться на снижении активности микробов в этом процессе (медь, железо, олово, цинк).
Уксус, получаемый из разведенного этанола, обычно не под- вергают "старению", так как оно не прибавляет каких-либо прият- ных вкусовых и обонятельных ощущений. Готовый уксус осветля- ют фильтрованием, разливают в стеклянные емкости и пастеризу- ют.
Выход уксуса оценивают по массе уксусной кислоты, содержа- щейся в целевом продукте, наработанном за сутки (кг/м3/сут.). Обычно эта величина довольно постоянна и равна 1,4 кг/м3/ сут. для обычных генераторов, 5—12 кг/м3/ сут. — для рециркуляци- онных генераторов.
Уже в течение четверти века совершенствуют метод глубинного культивирования селекционированных штаммов ацетобактерии с целью получения большего количества уксусной кислоты. Так, при периодическом выращивании А.асеи в глубинных условиях при 25—30°С на среде, содержащей 10—11% этанола, 1% уксусной кислоты и минеральные соли выход уксусной кислоты повышался до 18—23 кг/м3/сут. Более производительным стал непрерывный
418
процесс, реализуемый в батарее ферментаторов (например, изпяти емкостью 6 м3 каждый и соединенных последовательно). Исходная среда с 4% этанола, 1,5% уксусной кислоты и минеральными солями (моногидрофосфат аммония, дигидрофосфат калия, магния суль- фат), непрерывно поступает в первый ферментатор, обогащается спиртом в последующих ферментаторах. Таким образом происхо- дит обогащение среды уксусной кислотой при снижении концен- трации этанола (таблица 44).
Т а б л и ц а 44. Содержание уксуса при непрерывной глубинной ферментации Асе(оЬас(ег асе(1 в батарее из пяти ферментаторов
Концентрация, % |
№ ферментатора |
||||
1 |
2 |
3 |
4 |
5 |
|
Этанола |
2,6 |
1.8 |
1,6 |
0,9 |
0,2—0,15 |
Уксусной кислоты |
3,0 |
5,9 |
8,0 |
9,3 |
10,0 |
Из последнего ферментатора непрерывно вытекает уксус. Вы- ход уксусной кислоты достигает 30 кг/м3/ сут. и более.
Получение лимонной кислоты. Около 60 лет назад лимонную КИСЛСТу выделяли преимущественно йз плодов цитрусовых расте- ний. Теперь же основную массу 86 производят с помощью опре- деленных штаммов плесневого гриба АзрегдШиб гадег. В настоящее время ведущими производителями лимонной кислоты являются КНР, США, Франция, Россия и некоторые другие страны. Ранее, начиная с 1917 г., производство было основано на поверхностном культивировании микроба-продуцента; в 1938—1942 гг. освоено также глубинное культивирование в герметичных ферментаторах (см. главу 7). Благодаря этому удалось механизировать и автома- тизироватьпроцесс.эффективнееиспользовать производственные площади и снизить себестоимость целевого продукта, сократить общую продолжительность технологического цикла, облегчить под- держание асептичности в производственных условиях.
Ныне в производстве применяют селекционированные штам- мы Ашдег (например Р-3), дающие выход лимонной кислоты 98—99% в расчете на потребленную сахарозу и обладающие повы- шенной осмотолерантностью (при начальных концентрациях са- хара в питательной среде порядка 12%).
41У
Лимонная кислота, как трехосновная оксикарбоновая кислота, наряду с глюконовой, фумаровой и другими, является интермеди-
атом метаболизма в цикле трикар- он боновых кислот, когда имеет место
НООС—СН,—С—СН,—СООН неполное окисление соединений | 2 углерода в аэробных условиях. Ее
СООН сверхсинтез возможен при лимити-
ровании гриба — продуцента по железу и фосфору, при одновременном избытке в среде источника углерода и при низких значениях рН.
Лимонная кислота накапливается вначале в клетках продуцен- та, а затем выделяется в культуральную среду.
Вышеперечисленные факторы ингибируют такие ферменты, как аконитат-гидратазу, изоцитратдегидрогеназу и, возможно, а- кетоглутаратдегидрогеназу. Поэтому не происходит полного мета- болизма лимонной кислоты в ЦТК и ее можно получать в доста- точно больших количествах с коммерческими целями.
Поскольку основным сырьем для производства лимонной кис- лоты является меласса, в которой содержится много железа, то на стадии предферментации необходимо его осадить с помощью желтой кровяной соли — К4 [Ре(СЫ6)]. К тому же доказано, что эта соль и лимонная кислота в клетках выступают ингибиторами изоцитратдегидрогеназы.
Известны два способа ферментации Ашдег — поверхностный и глубинный. Первый из них реализуют на предприятиях малой и средней мощности в виде жидкофазной ферментации на жидкой среде (например, в ряде стран Европы и Америки) и в виде твердофазной ферментации (например, в Японии) на уплотненной среде. Технологическая схема жидкофазной ферментации пред- ставлена по Р. Я. Карклиньшу и А. К. Пробоку (1972) на рис. 132.
В отдельном цехе осуществляют наработку спор (конидий) гриба в виде трехстадийной схемы. В первую стадию Лшдег выращивают на скошенной агаризованной среде (например, на сусло-агаре) в пробирках, во вторую и третью стадии его размно- жают на плотной или жидкой среде соответственно в колбах Эрленмейера или в алюминиевых кюветах площадью 8,5—12 дм2 и с высотой бортиков от 7 до 20 см. Продолжительность каждой стадии — от 2 до 4 суток при температуре 32°С. При образовании и созревании конидий вначале бесцветный мицелий становится затем черным; конидии собирают по принципу аспирации (по лат. аврггаИо — вдыхание, надувание) специальным вакуумным насо-
420
сом, подсушивают в термокамере при 28-30°С, смешивают со стерильным активированным углем (1:2), фасуют в стерильные флаконы (колбы) и хранят в течение от полутора до двух лет. С 10 дм2 питательной среды в кюветах можно получить до 4—5 г сухих конидий. Подобный посевной материал может быть самостоятель- ным коммерческим продуктом, поставляемым на заводы лимонной кислоты.
Поверхностный способ жидкофазной ферментации А.шдег для промышленного производства лимонной кислоты реализуют в "бродильных камерах", где размещают на стеллажах названные выше кюветы (8—10 штук на один стеллаж) одну над другой. На дне каждой кюветы имеется сливной штуцер. "Бродильные каме- ры" оборудованы приточно-вытяжной вентиляцией, обеспечиваю- щей равномерный приток стерильного воздуха заданной темпера- туры и влажности (3—4 м3/м* мицелия • ч"1). Температура в камерах поддерживается на уровне 34—36°С, высота питающего слоя жид- кой мелассной среды 6—12 см. Максимальное тепловыделение (500—550 кДж/м2 • ч) имеет место к 5 суткам; исходная концентра- ция Сахаров в питательной среде в среднем порядка 12%; начальное значение рН 6,8—7,0 снижается до 4,5 в течение первых трех суток и до 3,0 — к концу процесса (8—9 сутки). Максимальное кислото- образование в таких условиях происходит на 5—6 сутки (100—105 г/м2 пленки гриба • ч"1, а затем стабильно удерживается на уровне 50-60 г/м2«ч'.
Из трех вариантов проведения технологического процесса (периодический, или бессменный; сменный и доливной) наилуч- шим оценивают доливной, когда через 6—7 суток от начала процесса ферментации (концентрация сахара снижается до 3—4%) подливают стерильный раствор мелассы без питательных солей — 30—35% начального объема (не забывать рационально использо- вать объем кювет при первоначальном заполнении питательной средой с учетом ее испарения). Таким путем добиваются продления цикла ферментации до 12 суток, а с этим на 30—35% возрастает количество перерабатываемой среды для получения целевого про- дукта. При сменном (одно- и многосменном) методе культуральную жидкость в конце ферментации сливают из-под пленки, пленку снизу промывают стерильной водой и под нее же заливают свежую стерильную питательную среду, содержащую только углевод и лишенную минеральных солей. Ферментацию продолжают еще 4—6 суток.
В собранной культуральной жидкости содержится смесь орга- нических кислот — лимонная, глюконовая, щавелевая и неисполь- зованный сахар в примерном соотношении 45—50:3:1:7, то есть лимонная кислота составляет от 80 до 90%. Ее выделяют химиче- ским путем — добавляют к нагретой до 100°С культуральной жидкости известковое молоко — Са(ОН)2 или мел—СаС03, доводя рН до 6,8—7,0; это количество составляет примерно 2,5—3%; трехзамещенный кальция цитрат, хуже растворимый в горячей воде, чем в холодной, выпадает в осадок вместе с кальция оксалатом (кальция глюконат остается в растворе); осадок отфильтровывают, промывают горячей водой и гидролизуют серной кислотой. Сво- бодная лимонная кислота остается в растворе, а негидролизован- ный кальция оксалат и образовавшийся гипс — Са504 остаются в осадке. Раствор лимонной кислоты очищают, подвергают вакуум- упариванию и кристаллизуют. Кристаллы кислоты высушивают и фасуют (рис. 132).
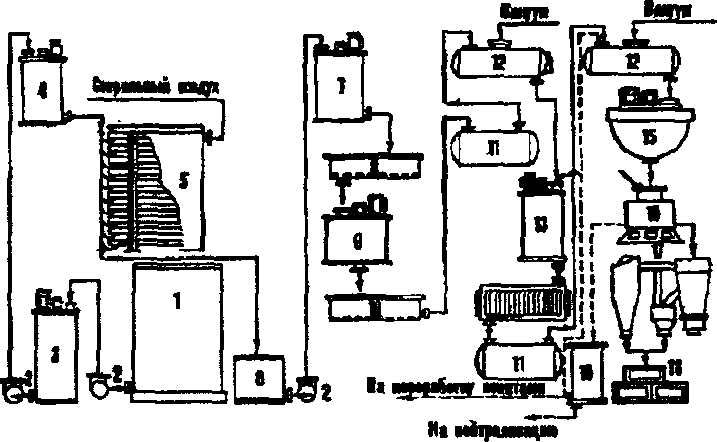
Мицелий продуцента либо используют для выделения фермен- та пектиназы, либо высушивают и поставляют на корм скоту и домашней птице (желательно — в обезвреженном — убитом виде); наконец, он может быть использован, как источник флавинов.
Твердофазная ферментация на уплотненных средах для пол- учения лимонной кислоты — наиболее простой способ из всех известных. Ферментацию определенного штамма А.шдег, рези- стентного к высоким концентрациям металлов (особенно — желе- за), содержащихся в семенах злаковых растений, проводят на увлажненных отрубях риса или пшеницы, находящихся в кюветах. Условия биосинтеза кислот при этом аналогичны условиям на
агаризованных или в жидких питательных средах. После оконча- ния процесса отруби экстрагируют водой, куда переходят кислоты, а затем выделяют цитрат кальция и чистую лимонную кислоту согласно схеме, изложенной выше.
Глубинный способ производства базируется на использовании специальных культур А.шдег ( в России применяют селекциони- рованный штамм № 288/9). Способ подготовки посевного матери- ала в виде конидий описан ранее. Инокулят подращивают сначала в инокуляторе, затем — в посевном аппарате (примерно в 1/10 объема основного ферментатора) на среде с 3—4% сахара. Спустя 1—1,5 суток инокулюм передают из посевного в основной фер- ментатор, где процесс ведут в течение 5—7—10 суток на аналогич- ной среде с трехразовым доливом 25-28% (по сахару) раствора мелассы с целью доведения конечной концентрации сахара в культуральной жидкости до 12—15%. После окончания фермента- ции (контроль — снижение кислотообразования) мицелий гриба отфильтровывают, а культуральную жидкость подвергают обра- ботке, как это описано выше.
Общая технологическая схема получения лимонной кислоты при глубинной ферментации А.шдег приведена на рис. 133.
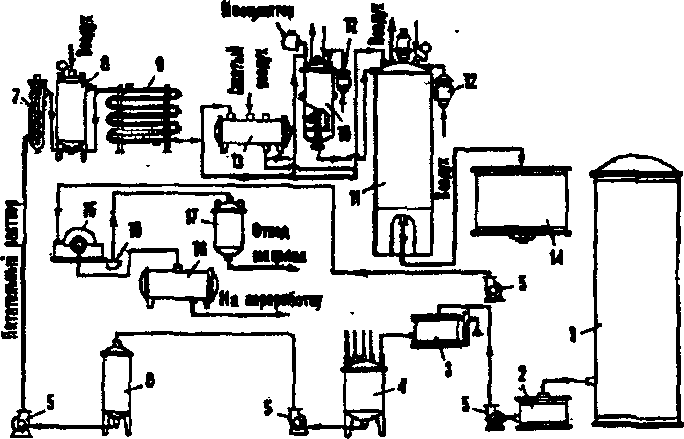
Согласно подсчетам глубинный метод экономически выгоден в тех случаях, когда мощность завода превышает 2,5 тыс. тонн лимонной кислоты в год, в противном случае поверхностный метод оказывается предпочтительнее из-за меньших энергозатрат и се- бестоимости продукции.
Лимонную кислоту широко используют в пищевой, медицин- ской, фармацевтической, лакокрасочной промышленности и в некоторых других отраслях народного хозяйства.
Лимонную кислоту можно получать из н-парафинов с помощью дрожжевых организмов рода СапйМа — С.Црогуйса, ОггоргсаНБ, С.рагар8По81Б, С.о1еорЫ1а, С.дшшегтопсш, С.2еу1апо1с1еБ. Наиболее активными из них являются дрожжи С.Црогуйса. К тому же другие виды (кроме С,.о1еоргша) относят к разряду условно патогенных.
Кроме лимонной дрожжи образуют на н-алканах трео-Ов-изо- лимонную, представляющую собою геометрический изомер ли- монной кислоты.
СН,—СООН ОН—С—СООН
I I
НО—С—СООН НС—СООН
I I
СН2—СООН Н2С—СООН
лимонная кислота трео-Ох-изолимонная
кислота
При лимитирований продуцента в азоте, фосфоре, сере и магнии, но при избытке в среде парафина, можно наблюдать сверхсинтез равных количеств обоих изомеров. Методами генети- ки и селекции получены мутанты, синтезирующие лишь один какой-либо изомер лимонной кислоты. Накопление целевого про- дукта может достигать 200 г/л и выше при выходе кислоты от использованного парафина более чем 140%.
Культивирование С.Црогуйса проводят в ферментаторах при интенсивных перемешивании и аэрации среды. В нашей стране отработаны методы получения лимонной и изолимонной кислот на н-алканах. Большая заслуга в этом принадлежит Т. В. Финоге- новой. Получаемые технические соли цитраты и изоцитраты имеют важное значение при изготовлении, например, моющих и других веществ.
Получение глюконовой кислоты. Используют селекционирован- ные штаммы АзрегдШив тдег, культивируемые в ферментаторах при интенсивных аэрации и перемешивании, поддерживая посто- янными температуру (30°С) и рН среды 6,0-7,0. Технологический процесс можно проводить в одном из двух вариантов нейтрализа- ции среды при ее закислении в ходе биосинтеза целевого продукта — мелом или раствором едкого натра. В первом случае исходная питательная среда должна содержать 10—15% глюкозы, поскольку кальция глюконат ограниченно рас/ворим в воде при 30°С (порядка
40 г/л); во втором случае образуется натрия глюконат, который хорошо растворим в воде (до 400 г/л при 30°С и 569 г/л ■— при 80°С) и поэтому концентрацию глюкозы в исходной среде можно повысить до 35%.
При использовании мела ориентировочный состава питатель- ной среды может быть следующим (%): 10—15 глюкозы; 0,016 — магния сульфата; 0,02 — калия дигидрофосфата; 0,04 — аммония гидрофосфата и 2,6 — кальция карбоната. Вместо глюкозы можно применять гидролизаты крахмала.
Если культуральную среду подтитровать раствором едкого на- тра (вместо нейтрализации мелом), то содержание глюкозы в среде доводят до 350 г/л; выход натрия глюконата тогда составит 95% от внесенного углевода.
Технологический процесс реализуют либо в периодическом, либо в непрерывном режиме. Второй из них более эффективен по скорости и по выходу целевого продукта (свыше 95% от использо- ванной глюкозы).
Механизм образования глюконовой кислоты связан с окисле- нием глюкозы кислородом при участии фермента глюкозооксида- зы (Е):
![]()
р-Ц-мюяно-^ипм
НО^СЧСНОЮд—СООН
глюкономя кислота
При этом вначале образуется Р-Б-глюконо-о-лактон, который затем гидролизуется до глюконовой кислоты.
Учитывая тот факт, что селекционированный штамм А.тдег продуцирует почти одну глюконовую кислоту, то для ее выделения в виде натриевой соли культуральную жидкость просто отфильт- ровывают от мицелия, упаривают и высушивают. В случае необ- ходимости получения кислоты, технический натрия глюконат пе- рекристаллизовывают и химически переводят в свободную кисло-
ту.
Аппаратурное оформление технологического процесса получе- ния глюконовой кислоты во многом напоминает производство лимонной кислоты глубинным методом.
Отделенный мицелий гриба используют для выделения фер- мента глюкозооксидазы, полезной в пищевой и фармацевтической промышленности. Глюконовую кислоту и ее соли широко приме-
няют на практике. Так, кальция глюконат является лекарственным препаратом, ускоряющим свертывание крови (его назначают при острых и хронических кровотечениях); натрия глюконат исполь- зуют для изготовления моющих средств, глюконовую кислоту применяют в фотографии, литографии, в изготовлении красок, для очистки металлов и т. д.
Получение итаконовой кислоты. Итаконовая, или метиленян-
Н00С~Нг<'—аТ?^ синтезируется плесне-
тарная кислота ^,,,~~Ёйн.~гт,» \-
v итакономя кислота выми ГрибаМИ ИЗ РОДЭ
Азрегдшив и, в частности, АЛасошсиз и АЛеггеиб. Промышленное производство базируется на использовании АДеггеив. Образование итаконовой кислоты из углеводных источников сопряжено с ЦТК и непосредственным ее предшественником является цис-аконито- вая кислота:
1 -Ш -СО?
НООС——С-СН2 —СООН -а-» НООС—Ш2—С==СН—СООН —
соон соон
лимонная кислота цис-аконитовая кислота
НООС—СН2—С=СН2
соон
итаконовая кислота
Реакцию дегидратации лимонной кислоты катализирует фер- мент аконитат-гидратаза, а декарбоксилирование происходит при участии аконитатдекарбоксилазы, обнаруженной у АЛеггеив.
Технологический процесс получения итаконовой кислоты схо- ден с процессом получения лимонной кислоты, то есть фермента- цию продуцента осуществляют либо поверхностным, либо глубин- ным методом, используя в качестве посевного материала конидии гриба — отселекционированного высокопродуктивного штамма А.1еггеи8 (например, ЭУУ-417).
Поверхностное выращивание продуцента проводят в кюветах, глубинное — в ферментаторах, оборудованных мешалками и бар- ботерами.
Итаконовая кислота в концентрации 7% йнгибирует рост про- дуцента, поэтому в процессе ее биосинтеза необходима нейтрали-
426
зация кислоты каким-либо основанием. Для этой цели чаще ис- пользуют аммония гидроксид, с помощью которого поддерживают рН среды равным 3,8 и добиваются образования 15СН-200 г/л целевого продукта. Активаторами биосинтеза итаконовой кислоты выступают катионы магния, меди и цинка. Источником углерода, как правило, служит меласса, разбавляемая водой до 8%-го содер- жания углеводов. Туда же добавляют (г/л) магния сульфат — 4,5, аммония нитрат — 2,5, цинка сульфат — 0,0044, кукурузный экстракт —4 мл, желтую кровяную соль — 0,25. Эта среда или близкие к ней другие варианты сред применяют для поверхност- ного и глубинного (при уменьшении сахара на 1—2%) культивиро- вания продуцента. Уровень рН среды, равный 1,8—2,3, является оптимальным для биосинтеза итаконовой кислоты. Длительность культивирования в кюветах обычно составляет 10—12 дней при 35°С; в случае глубинного культивирования длительность процесса сокращается до 2—3 суток при аэрировании со скоростью 1/8 объема воздуха в минуту на один объем среды. 1
Выход итаконовой кислоты в первом случае достигает 36—38% в расчете на 100 г потребленной глюкозы, во втором — 65% и выше.
После окончания ферментации мицелий сепарируют, промьтд. вают, отжимают и передают в сборники отходов; культуральн,уК) жидкость осветляют активированным углем, упаривают менее,, чем до 1/10 первоначального объема и передают на кристаллизацик итаконовой кислоты. После этого ее центрифугируют, высуши ют и фасуют. Дополнительную очистку кислоты можно пров' перекристаллизацией ее из 25% водных растворов.
Итаконовую кислоту применяют в химическом син кокачественных смол, волокон типа "нитрон", детерг' ственных веществ, красителей и других органическ~
Из других органических кислот, синтезируг целиальными грибами (например, КЫхорив г' время привлекала внимание ученых ф ут т а, являющаяся транс-изомером цис-ма •
Н—С—СООН
II
СООН—с—н
фумаромя кислота
Фумаровая кислота способна трансформироваться в малеино- вую, широко используемую для химического синтеза некоторых лекарственных веществ, смол, лаков и красок. Однако конкурен- тоспособность синтетического малеинового ангидрида (из бензи- на) для тех же целей служит веским ограничителем развития производства фумаровой кислоты путем микробного синтеза. И, очевидно, это будет продолжаться до тех пор, пока нефтяные запасы в мире значительно не оскудеют.
9.3.3. Получение антимикробных веществ. К антимикробным средствам относят антисептики, дезинфектанты и химиотерапев- тические вещества. Антисептики — это химические вещества, неизбирательно и губительно действующие на микроорганизмы (в том числе — патогенные), находящиеся на поверхности тела и слизистых оболочек открытых полостей. Дезинфектанты — это, в основном, антисептики, действие которых направлено на пато- генные микроорганизмы, находящиеся на (в) объектах внешней среды. Химиотерапевтические средства — это вещества синтети- ческого и природного происхождения, избирательно и губительно действующие на патогенные микробы, клетки злокачественных опухолей и гельминты.
Антисептики, дезинфектанты, неорганические и синтетиче- ские химиотерапевтические средства не имеют непосредственного отношения к биотехнологии. В то же время подавляющее боль- шинство антибиотиков получают при ферментации микробов-про- дуцентов, или, в других случаях, применяют "антибиотическое ядро" для синтеза целевого продукта — полусинтетического анти- биотика. Известны единичные антибиотики (ранее получаемые с помощью биосинтеза или получаемые таким путем и ныне), кото- рые в настоящее время производят на предприятиях органического синтеза (левомицетин и некоторые другие).
Таким образом, определение понятия "антибиотики" теперь относят к веществам природного, полусинтетического и, реже, синтетического происхождения, которые в малых концентрациях ингибируют рост (размножение) каких-либо микроорганизмов. Продуцентами одних антибиотиков (например, бацитрацина, по- лимиксина и др.), являются бациллы, других — актиномицеты (например, актиномицинов, гентамицинов, канамицинов), третьих — нитчатые грибы (например, гризеофульвина, пенициллинов, цефалоспоринов), четвертых—неспорообразующие бактерии (на- пример, монобактамов).
Антибиотики — В-лактамы
Пенициллин ы. Пенициллин впервые получен из культуральной жидкости в аморфном, а затем—в кристаллическом виде А. Флемингом, X. Флори и Е. Чейном в 1940 г. До сих пор пенициллиновые антибиотики составляют наиважнейшую группу химиотерапевтических средств. Ядром пенициллинов является 6- аминопенициллановая кислота, или 6-АПК, которую используют для получения полусинтетических пенициллинов.
-СН-СН
С=(СНз)2
^С—
N —СН—СОО
6-АПК спектр полусинтетического производно-
го. Обычно 6-АПК получают из бензил- пенициллина (пенициллина С). В настоящее время в различных странах производят биосинте- тические (с помощью РешсШшт поШшп или Р.стуБодепит) ан- тибиотики и на их основе — полусинтетические антибиотики — Р-лактамы, перечисленные в таблице 45.
Цефалоспорины — другая обширная группа экстрацеллюлярных Р-лактамных антибиотиков, в которых шести- членное дигидротиазиновое кольцо соединено с Р-лактамным коль- цом. Благодаря этому ядром цефалоспоринов является 7-аминоце- фалоспорановая кислота, или 7-АЦК (цефемовое ядро), впервые
ООО"
7-АКЦ
К,
="ООС—СН—(СН2)3—СО—;
Ан2
Я2=—О—СО—СН3
выделенная
в ходе очистки
цефалоспорина С
(проду-
цент
СерЬа1оБрогшт
асгетопшт), в котором
г
Известно
около 20 це-
фалоспоринов,
созданных
методом полусинтеза
из
АЦК: цефалоридин (цепо-
рин),
цефуроксим, цефок-
ситин, цефалотин,
цефа-
цетрил, цефалексин, цефа-
золин,
цефаридин, цефо-
таксим, цефтриаксон,
цеф-
тазидим и др.
Т а б л и ц а 45. Природные и полусинтетические пеницидлины
Название |
Радикал, К |
Эффек- тив- ность рег 08 |
Устойчивость к р-лактамазам |
Гидро- лизует- ся после всасы- вания |
|
Зтарп. аигеив |
грам- отрип. бакте- рий |
||||
Бензилпенициллин |
* Бензил |
— |
— |
— |
— |
Феноксиметил- пенициллин |
Феноксибензил |
+ |
— |
— |
|
Метициллин |
2, 6- Диметоксифенил |
— |
+ |
|
|
Оксациллин |
5-Мегил-З-фенил- 4-изоксазолил |
+ |
+ |
+ |
|
Клоксациллин |
3-о-Хлорфенил- 5-мегил- 4-изооксазолил |
+ |
+ |
+ |
|
Флуклоксациллин |
2-Хлор-6-фтор- фенил-5-метил- 4-изоксазолил |
+ |
+ |
+ |
|
Ампициллин |
а-0-(-)-аминобензил |
+ |
— |
— |
— |
Амоксициллин |
р-Окси-о>0-(-)- аминобензил |
+ |
— |
— |
|
Карбенициллин |
Натриевая соль а-Ю- (-)-карбоксибензил |
— |
— |
|
|
Тикарциллин |
Натриевая соль карбокси (тиен- 3-ил) ацетил |
— |
— |
+ |
|
Карфециллин" |
Фенил (феноксикарбонил) -ацетил |
+ |
— |
+ |
+ |
Кариндациллин* |
Инден-5-ил- оксикарбонилфенил- ацегил |
+ |
— |
+ |
+ |
Пивампициллин* |
Аминофенилапеггил |
+ |
— |
— |
+ |
 Примечание:
'эфиры
карбенициллина; *эфиры ампициллина;
**замещенные ампицил-
лины;
**6-в-амидинозамещенные пенициллины; в
позиции 3 тиазолидино-
вого цикла (в
форме сложного эфира): "-пивалоилоксиметил,
°°3-окСо- 1,
З-дигидроизобензофуран-1-ил,
+2-этоксикарбонилоксизтилили
4-эток-
сикарбонилоксибутил; (+)
— ответ положительный; (—) — ответ
отрица-
тельный; (о) — не действует
на грамположительные бактерии; (?)
—
информация
отсутствует.
Примечание:
'эфиры
карбенициллина; *эфиры ампициллина;
**замещенные ампицил-
лины;
**6-в-амидинозамещенные пенициллины; в
позиции 3 тиазолидино-
вого цикла (в
форме сложного эфира): "-пивалоилоксиметил,
°°3-окСо- 1,
З-дигидроизобензофуран-1-ил,
+2-этоксикарбонилоксизтилили
4-эток-
сикарбонилоксибутил; (+)
— ответ положительный; (—) — ответ
отрица-
тельный; (о) — не действует
на грамположительные бактерии; (?)
—
информация
отсутствует.
Боковые цепочки, содержащие 2-аминотиазолил как в цефо- таксиме, цефтриаксоне, цефтазидиме и некоторых других, усили- вают активность цефалоспоринов против стрептококков и грамот- рицательных бактерий; иминометоксигруппа в той же позиции, например, в цефуроксиме, обеспечивает стабильность антибиоти- ка против плазмидо-опосредованных Р-лактамаз, и т. д.
1-Оксацефемы — сходны с цефалоспоринами, у которых атом серы в дигидротиазиновом {цефемовом) кольце замещен на
431
N п—С—СО
ЛТП
5 N—ОСН3
—о— со—сн3
О-ацвтил
цефотшссмы
2
01—ютивзоп-4-«>
(матокс
ними
ю)ацетял
радикал тот ж*
цмртривксон
Б-™дрО«С1»-2-МвТИГ1-
5-<жсс-2,5-двг»|Дро- -1,2,4-триазин-З-ип -тио...и«триевая соль
и,и
сн,
I
О с—СООЫа
I
сн3
О
пиридил
цефтаэидиы
2-ш*нио-ОЧ1нарбоаси 1,1-ди«»втил)-4-тмвэол-
нвтримая соль
кислород. Представителем такой группы антибиотиков является широкоспектральный латамоксеф(мексалактам), в котором 7-сх-метоксигруппа стабилизирует молекулу, как таковую, равно как и придает устойчивость и к большинству р-лактамаз.
ю-
I I
осн3 о
0=С—N.
СООЫв
С—СН2—8
СООМа
СНч
Клавами — В-лактамные антибиотики, отличающиеся от пенициллинов тем, что в тиазолидиновом кольце последних сера заменена на кислород [клавемовое оксазолидиновое кольцо) и в позиции 6 нет боковой цепи. Та- кой антибиотик — клавулановая
кислота изолирована из сн _сн$ с«СН—СН2ОН
51гер1отусеБ с1алд1ИдетБ. Она 1* I I
слабо активна против бактерий, I? ^ ^,'н
но является потенциальным ин- ""'ч^^^..
к ^ - п 'СООН
гибитором стафилококковой р-
„ ^ хпавугановая кислота
лактамазы и р-лактамазы, обра- зуемой грамотрицательными
бактериями. Сочетание широкоспектральной клавулановой кисло- ты с В-лактамазочувствительными ампициллином и амоксицилли- ном является основой комбинированного препарата аушеялшн.
1 — Карбапенемы — это новое семейство Р-лактамных антибиотиков, представляющих собой аналоги пенициллинов или клавамов, в которых сера у первых и кислород у вторых замещены на углерод:
С Но
тгр—СН гСН
I I, Л
о=с— 1Г—сн
1-карбапенемовое кольцо
К этому семейству относятся оливановые кислоты и тиенами- цин. Их продуценты — стрептомицеты. Эти антибиотики обладают широким * антимикробным спектром и являются выраженными ингибиторами В-лактамаз.
сн3 " I си- нц, I -■/ \ .к
■с—с—с
ма°з8° о=с— .У-соом.
общее строение оливановьи кислот (продуцент - Бйсрйтусе» оЕтасеш)
он | I II
0=С N С—СООЫа
сн3
(
тненаынрн (продуцент - 51гер1отусе5 оЬасеш)
Нокардицины — новая группа.р-лактамных антибиотиков, продуцируемых бактериями из рода 1Чосагсиа. Выделены нокарди- цины А, В, Б, Е, Р, С. Наиболее активным из них против грамот- рицательных бактерии (но не грамположительных) оказался но- кардицин А.
сн—сн2—СН2 ДОН й и
о=с—\ ноос^4
мокардицин А (продуцент - ЫокэгсКа 5р.)
Монобактамы — это моноциклические монобактамные антибиотики, продуцируемые штаммами бактерий, например Рвеисютопаз аасюргша и С1исопоЪас1ег Бреаев. Их ядром является 3-аминомонобактамовая кислота (3-АМК). Ее можно получить из природных монобактамов или из 6-АПК.
Природным высокоактивным против грамотрицательных бак- терий и устойчивым к действию рЧлактамаз оказался азтреонам. Однако он не активен против грамотрицательного анаэроба Вас1его1<ЗеБ ггадШв, способного продуцировать Р-лактамазу, актив- ную против данного антибиотика. Комбинация клавулановой кис- лоты с монобактамами также неэффективна против этого микроба.
"А. II „
,С N.
соон
аэтреонвм (продуцент - Рхеискмтюпах асУорЬва)
Антибиотики-тетрациклины — это широкоспектральные антибиотики, активные против бактерий;'их продуцентами являются стрептомицеты. Некоторые тетрациклины относятся к ряду полусинтетических препаратов.
Антибиотики-гликозиды. Среди них можно выделить структуры, содержащие О-, 5- и Ы-гликозидные связи. К числу первых относят аминогликозидные антибиотики и ново-
434
биоцин,
ко вторым — клиндамицин и линкомицин,
к третьим —
некоторые нуклеозидные
антибиотики.
Антибиотики
—
О-гликозиды.
Аминогликозиды
—
содержат аминосахара в своей структуре.
Большинство из них
(канамицины,
гентамициныи др.) продуцируется
актиномицетами;
тобрамицин
—
аналог канамицина В (З'-дезоксиканамицин
В);
яелщллшццн является полусинтетическим
производным сизомици-
на
(N-зтилсизомицин).
Все
антибиотики-аминогликозиды обладают
широким спект-
ром действия на
различные патогенные бактерии.
К,
я, тичидияы
ин2
он л
он
нн2
с
(продуцент
- 5<гр(сту«х 1шч(Т|усе11сиз)
Т'
СН, МНСН, н НН)
Н нн2
<=3
сн3нн 'он
он
но
«Ни
НО |
о^, ^2ынсойн(СН2)2ын2
СН?ОН
![]()
он
ИН2
но
НО.
(полусжпппасай
аамнятлшоми •
приваоднрвют—щш)
Его продуцентом является мутант М1сготопоБрога Бадапиепвгз КУ11535.
Антибиотики — макроли- д ы — имеют О-гликозидные связи; они продуцируются стрептомицетами и прояв- ляют активность против большинства грам-
Продуцентом ген- тамицинов является М1сготопозрога ригригеа, а сагамици- на — М.5адат1е81Б. Сизомшщн по строе- нию близок гентами- цинам и отличается от них лишь одним цик- лом
положительных и некоторых грамотрицательных бактерий (Ыекзепа врр., Наеторпиив тПиепгае и Ьедюпе11а рпешпорЫ1а). На практике чаще применяют эритромицин, олеандомицин, три- ацетилолеандомицин и спирамицин. Они содержат в своей струк- туре макроциклическое лактонное кольцо, связанное с углеводны- ми остатками, из которых аминосахар (если имеется) всегда рас- полагается ближе к макролактону, чем нейтральный углевод.

спирамицин | (продуцент - Ягерботусм атЬЫжимв)
Олеандомицин, его эфир—триацетилолеандомицин и спирамицин сходны по спектру антибактериального действия с эритромицином, но несколько слабее его по активности.
Новобиоцин продуцируется культурой 51гер1отусеБ врЬегоШев и другими видами. Антибиотик активен против возбудителей пневмонии, некоторых кишечных и раневых инфекций, ангин и флегмон. По химической структуре — это О-гликозид (амидогли- козид), агликон которого существенно массивнее углеводной час- ти.
Оливомицин — О-гликозидный антибиотик, в котором сахари- стая часть представлена триаозой и биозой, между которыми как бы "вставлен" агликон-оливин (хромомицинон).
Оливомицин является представителем большой группы анти- биотиков — аналогов ауреоловой кислоты (митрамицина), актив- ных против грамположитёльных бактерий и отдельных опухолей. Оливомицин продуцируется 51гер1ошусеБ оШгогеисиИ.
Дауномицин (рубомицин) — О-гликозидный антибиотик из группы, антрациклинов, образуемый Зтгер1отусеБ врсаев. Углевод- ный компонент в нем — даунозамин, или 2, 3, 6-тридезокси-З-ами- ноликсоза. Антибиотик обладает противомикробным и противо- опухолевым действием.
Иммуносупрессивным
и противсюпухолевым действием обла-
дает
О-гликозидный антибиотик блеомицин,
содержащий
также и
пептидные связи. Он образуется
стрептомицетом; углеводный
компонент
в нем представлен.амидобиозой.
Ристомицин
А (ристоцетин) —
О-гликозидный антибиотик, в
составе
которого имеется циклизованная
агликоновая часть (цик-
лопентит) и
углеводный компонент, включающий
ристозамин,
маннозу, арабинозу,
глюкозу и рамнозу. Ристомицин
активен
против грамположительных
бактерий.
Антибиотики
—
5-гликозиды
Из
этой группы антибиотиков наиболее
известны лцнкомццин
и клиндамицин,
агликоном
которых является метил. Другими сло-
вами
— это метил-5-гликозиды. Из них клиндамицин
является
производным линкомицина,
у которого гидроксил в позиции 7
заменен
на хлор.
СН3
(продуцент
- 5к*ркхпусвз Ипко«тепзв)
Углеводная
часть обоих антибиотиков представлена
6, 8-дидё
зокси-1-тио-0-эритро:0-галакто-октапиранозой,
в которой С6 име-
ет радикал —
1-метил-4-н-пропил-2-пирролидин-карбоксамид.
437
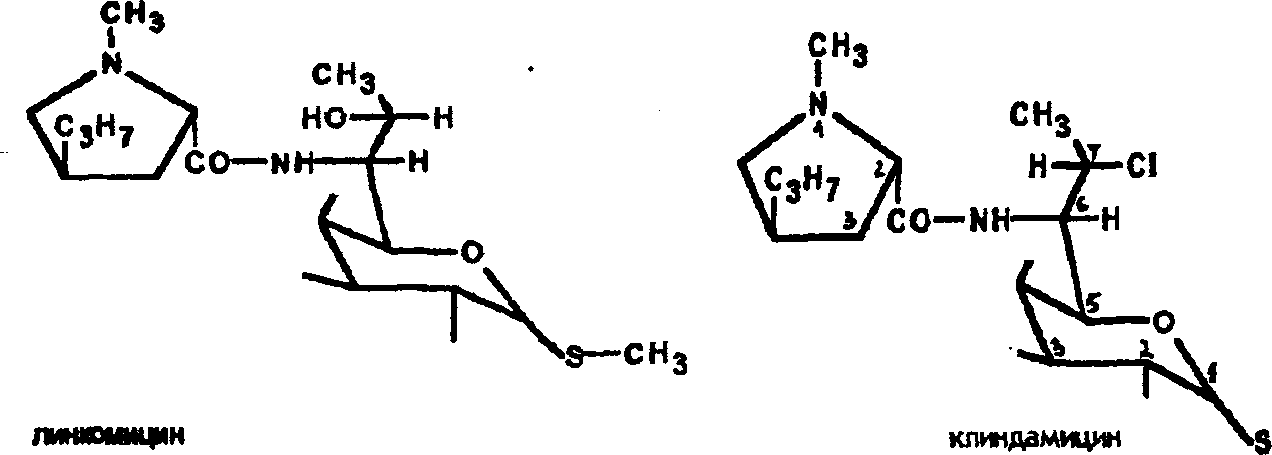
Клиндамицин лучше всасывается в кровь из кишечника. Оба антибиотика активны преимущественно против грамположитёль- ных кокков.
Антибиотики — №г ликозиды

гужеротин
СН3—ИН—СН2—СО—С|Н—со—нм, СН2ОН
Пуромицин — И-гликозидный антибиотик, имеющий важ- ное значение в расшифровке синтеза белка на рибосомах. Он подобен З'-концу аминоацил-тРНК, связывающемуся с опреде- ленным участком рибосомы, и действует как аналог аминоацил- тРНК, прерывая удлинение полипептидной цепи.
Продуцентом пуромицина является Зггеркэгпусев а1Ьотдег. Хо-

 тя
антибиотик ингибирует
многие
микроорганизмы,
включая трипаносомы,
те-
рапевтическое значение
его
невелико.
тя
антибиотик ингибирует
многие
микроорганизмы,
включая трипаносомы,
те-
рапевтическое значение
его
невелико.
Антибиотики-
депсипептиды
Все они продуцируют- ся, как правило, бациллами и проявляют активность против грамположитёль- ных и/или грамотрицатель- ных патогенных бактерий. К числу циклопептидных антибиотиков относят ба- цитрацины, грамицидины, полимиксины и др.:
продуцент
Вас. ИсЬеш1опп18
антибиотик
бацитрацины
(10 форм)
активен против
грамположи- тёльных бактерий и грам- отрицательных кокков
Вас.
ЬгелдБ уаг.С.-В.
Вас. ро1утшха Вас. сигси1апв
(5 форм) полимиксины,
колистины, грамотри-
циркулины цательных
(22 формы) бактерий
Полимиксин В|, циркулин А и колистин различаются по еди- ничным аминокислотам в циклах.
К циклопептидным антибиотикам относится также циклоспо- рин А, продуцируемый мицелиальными грибами Су1т<1госагрит шаёшп и То1урос1агИшп 1гШа1шп-Вашгепа шуев (рис. 134). Приме- чательным качеством антибиотика является иммуносупрессивное действие, в связи с чем его преимущественно используют в трансплантологии, хотя он также проявляет антифунгальную ак- тивность.
 Антибиотики-акти-
номицины
составляют
большую группу сходных
ве-
ществ, образуемых стрептоми-
цетами.
Некоторые из них обла-
дают
противоопухолевым и им-
муносупрессивным
действием.
По химическому строению
их
относят к хромопептидам, со-
держащим
феноксазиновую
хромофорную группу
и два пен-
тапептида в форме
циклических
лактонов. На практике
хорошо
известен актиномицин
(дакти-
номицин), ингибирующий
ДНК-зависимый синтез РНК.
А н т и б и
о т и к и - п о л и е н ы
Антибиотики-акти-
номицины
составляют
большую группу сходных
ве-
ществ, образуемых стрептоми-
цетами.
Некоторые из них обла-
дают
противоопухолевым и им-
муносупрессивным
действием.
По химическому строению
их
относят к хромопептидам, со-
держащим
феноксазиновую
хромофорную группу
и два пен-
тапептида в форме
циклических
лактонов. На практике
хорошо
известен актиномицин
(дакти-
номицин), ингибирующий
ДНК-зависимый синтез РНК.
А н т и б и
о т и к и - п о л и е н ы
Продуцентами антибиотиков-полиенов являются стрептомице- ты и некоторые мицелиальные грибы, образующие структуры с
439
четырьмя-семью сопряженными двойными связями (тетра-, пента-, гекса- и гептаены). Из группы полиеновых антибиотиков в меди- цинской практике известны нистатин, фумагиллин (тетраены), амфотерицин В (гептаен) и полусинтетический амфоглюкамин, обладающие противогрибковым действием (преимущественно — в отношении патогенных дрожжевых организмов и некоторых других диморфных грибов); фумагиллин ингибирует стафилокок- ки, дизентерийную амебу, бактериофаги. Нистатин (продуцент 51гер1ошусев поигзе!) — аналог амфотерицина В, но в его цепочке (позиции 20—27) содержится 4 конъюгированных двойных связей.
Антибиотики-анзамицины (от лат. апза — ручка). В их молекулах к ароматическому ядру присоединяется алифати- ческая анза-цепь. Анзамицины образуются актиномицетами и некоторыми растениями. Из природных и полусинтетических ри- фамицинов наиболее известными являются: рифоцин (рифампи- цин 5У), рифампицин и рифамид. Анзамицины — щирокоспект- ральные антибиотики, йнгибирующие бактерии, отдельные вирусы и некоторые эукариотические клетки.
• Рифампицин (продуцент — 5ггер1отусеБ тесн1еггапе1) расцени- вают одним из лучших химиотерапевтических средств при тубер- кулезе, проявляющим бактерицидное действие против МусоЪас1епшп 1иЬегсшо51з. Он проникает в спинномозговую жид- кость и поэтому эффективен при туберкулезном менингите.
Антибиотики-стероиды — к ним относят фузидиевую кислоту, изготавливаемую в виде натриевой соли. Она образуется мицелиальным грибом Ривапшп сосстешп. Антибиотик активен против многих типов грамположительных бактерий, особенно — стафилококков.
Пр очие антибиотики
Гризеофульвин — продуцируется нитчатым грибом РешаШшп дп5ео1и1уит и другими, активен против болезнетворных грибов- дерматофитов. Он состоит из конденсированных колец А, В, С.
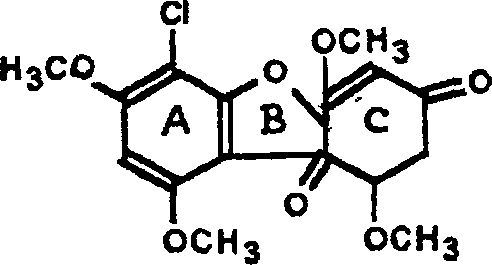
водства. В своем составе содержит гриэеофулмин гетероциклы.
с.
ОС
о—
св=сн—сн3
В главе 7 приведены технологические схемы производства пенициллина и канамицина, поскольку предферментационные и ферментационные стадии во многом подобны, то нет необходимо- сти рассматривать технологию производства каждого антибиотика в отдельности.
Так как антибиотические вещества являются вторичными ме- тоболитами, то биосинтез их сопряжен с переходом культуры продуцента в идиофазу. Следовательно, здесь целесообразно ли- митирование роста продуцента. Таким лимитирующим ингредиен- том (фактором) при биосинтезе пенициллина выступает глюкоза, тогда как при биосинтезе антибиотиков стрептомицетами — фос- фаты. Все это важно при "компановке" питательных сред, подкор- мке штамма - продуцента в процессе биосинтеза антибиотика. Так, среда для продукции пенициллина (она же пригодна для накопле- ния инокулюма) включает глюкозу — 1,5%, лактозу — 5% (лактоза снимает катаболитную репрессию глюкозы), аммония сульфат и фосфаты — 0,5—1%, кукурузный экстракт — 2—3%, предшествен- ники антибиотика — фенокси- или фенилуксусная кислота — 0,3—0,6%, мел — 0,5-1%, пеногаситель — 0,5—1%; температуру ферментации поддерживают на уровне 22—26°С при рН от 5,0 до 7,5 и аэрации 1 м3 воздуха на 1 м3 среды в 1 минуту; продолжи- тельность ферментации — 4 суток.
Так называемая "всеядность" актиномицетов обеспечивает им способность расти и продуцировать антибиотики на средах, содер- жащих белки (соевая мука, рыбная мука, белок клейковины пше- ницы и пр.), крахмал. Тем не менее, применительно к каждому продуценту имеются свои особенности, обычно отмечаемые в регламентной документации. Например, посевной материал 51гер1отусев капатусейсив получают на соево-крахмальной среде и на ней же проводят основную ферментацию при 27—28°С в течение 4—5 суток при поддержании рН на уровне 7,1-7,6.
При ферментации 51г. Попйае (продуцент виомицина, или флоримицина) рекомендуют среду, содержащую глюкозу или гид- рол, соевую муку, кукурузный экстракт, нитраты, мел; температуру поддерживают в пределах 27—29вС, рН на уровне 7,0—7,3.
В случае ферментации 51г. егуШгеив в питательную среду добавляют пропиловый спирт, как предшественник антибиотика эритромицина.
Продуцент нистатина 51г. поигве! интенсивно потребляет аммо- нийный азот (не нитратный), и т. д.
Перед выделением антибиотика из культуральной жидкости необходимо отделить твердую, или плотную фазу от жидкой. В этих случаях, как правило, используют фильтрацию. Качество твердой фазы заметно сказывается на эффективности фильтрации. Здесь можно отметить следующую закономерность — нативная бактериальная масса фильтруется хуже мицелиальной. С учетом того факта, что высшие актиномицеты способны формировать нитчатые структуры, то их отделение при фильтрации происходит несколько легче, чем других бактерий.
Пути улучшения фильтрации: обработка культуральных жид- костей электролитами, тепловая коагуляция, добавление фильтру- ющих наполнителей, кислотная коагуляция и некоторые другие.
Трудности выделения антибиотиков обусловлены многокомпо- нентностью культуральных жидкостей и малой концентрацией в них целевых продуктов. Так, пенициллин может накапливаться примерно до 30 г/л при 8%-м выходе от субстрата. При этом сухие выщества после отделения мицелия обычно составляют порядка 3—6%, из которых лишь 15—30% приходятся на антибиотик. Поэ- тому любую культуральную среду необходимо обрабатывать так, чтобы антибиотическое вещество переходило в ту фазу, из которой затем он будет наиболее полно выделен. В ряде случаев этого можно добиться подкислением (тетрациклины) или, напротив, подщела- чиванием культуральной жидкости (новобиоцин), добавлением
солей, щавелевой кислоты (эритромицин) и т. д., до или после коагуляции и осаждения белков из нативных растворов.
Если для выделения антибиотика применяют ионный обмен, то нативный раствор стремятся освободить от ионов-конкурентов (растворимые оксалаты — для удаления ионов кальция; натрия триполифосфат — для связывания ионов магния; желтая кровяная соль — для комплексования ионов железа).
Антибиотические вещества, накапливающиеся в клеточной биомассе в процессе ферментации микробов-продуцентов, выде- ляют другими методами, нежели антибиотики, содержащиеся в культуральной жидкости. В первом случае, как правило, необхо- дима экстракция каким-либо растворителем из нативных или дезинтегрированных клеток (система "твердое тело-жидкость").
Примерная схема выделения целевого продукта (антибиотика) из культуральной жидкости может быть представлена в следующем виде (рис. 135). В приведенную схему должны быть внесены соответствующие коррективы в зависимости от физико-химиче- ских характеристик целевого продукта и возможностей аппара- турного оформления процесса. В настоящее время все большее распространение приобретают мембранные методы концентриро- вания и выделения различных веществ, хотя до сих пор в ряде производств БАВ (включая антибиотики, например, пенициллин) не удалось отказаться от традиционных способов выделения и очистки целевых продуктов (экстракция в системе "жидкость-жид- кость", адсорбция на активированных углях, диализ).

— подготовка раствора для ■ фильтрации, 6 — дополни- \х тельная фильтрация, 7 — сте- ' рилизующая фильтрация, 8—
коагуляция растворителем, 9
— предварительное осажде- ние, 10—промывание осадка,
— вторичное осаждение,
— высушивание.
В сравнительном плане следует иметь в виду, что механическое обезвоживание заметно дешевле термического и это сказывается на себестоимости производимого продукта.
Широко используют методы хроматографии, например, при выделении новобиоцина, стрептомицина и других антибиотиков. В подобных случаях технологическая схема аппаратурного офор- мления процессов заметно упрощается.
9.3.4. Получение аминокислот. Аминокислоты играют большую роль в здравоохранении, животноводстве и легкой промышленно- сти. По значению для макроорганизма аминокислоты подразделя- ют на заменимые и незаменимые. К незаменимым относят те аминокислоты, которые не синтезируются в человеческом и/или животном организме, они должны быть привнесены с пищей или кормом для животных (таблица 46).
Т а б л и ц а 46. Незаменимые и заменимые аминокислоты
Незаменимые |
Заменимые |
Аргинин (только для молодых растущих животных) |
Алании |
Валин |
Аспарагин |
Гистидин |
Аспарагиновая кислота |
Изолейцин |
Глицин |
Лейцин |
Глутамин |
Лизин |
Глутаминовая кислота |
Метионин |
Пролин |
Треонин |
Серии |
Триптофан |
Тирозин |
Фенилаланин |
Цистеин |
Заменимые синтезируются т лпуо из аммиака и различных источников углерода. Микроорганизмы сами синтезируют все необходимые им аминокислоты из аммиака и нитратов, а углерод- ные "скелеты" — из соответствующих интермедиатов.
Исходя из такой оценки аминокислот, ученые давно стремятся использовать способности микроорганизмов продуцировать заме- нимые и незаменимые аминокислоты в ощутимых количествах.
444
Потребность людей в аминокислотах достаточно велика и этим определяется уровень их производства в мире (порядка 500 тыс. тонн в год).
Специфические ферменты, регулирующие биосинтез амино- кислот, широко распространены у бактерий; они с определенной глубиной изучены у ЕвсЪепсЫа сон, ЗашюпеИа гурЫтштшп, ВасШив виЫШв и пр. У грибов, в ответ на аминокислотное лимити- рование, отмечается некоординированное, параллельное возраста- ние уровня ферментов, катализирующих реакции биосинтеза раз- личных аминокислот. Этот "общий контроль биосинтеза амино- кислот" был также назван "метаболическим интерблоком", или "перекрестнопутевой регуляцией", впервые выявленной у Ыешоврога сгавва в 1965 г. М. Карсиотисом и сотрудниками, а позднее — у ЗассЬаготусев сегеУ1в1ае, АврегдШив тёшапв и других грибов.
В гиперпродукции отдельных аминокислот культурами Е.соП, ЗеггаМа тагсевсепз и др. важную роль играют РеейЬаск-ингибиция и РееёЬаск-репрессия, например, при биосинтезе ароматических аминокислот на последних стадиях. Штаммы — суперпродуценты, эксплуатируемые в производстве, как правило, получены с исполь- зованием методов генетики и селекции.
В любом живом организме аминокислоты расходуются прежде всего на биосинтез первичных метаболитов — ферментных и неферментных белков. Следовательно, кроме биосинтеза амино- кислот йе пото.возможен другой путь их получения, а именно — из гидролизатов соответствующих белков (триптофан разрушается при кислотном гидролизе), в том числе — из нативной биомассы микробных клеток.
Природные аминокислоты являются, как правило, оптически активными Ь-формами, тогда как аминокислоты, получаемые хи- мическим синтезом, являются рацемическими смесями Ь- и О- форм, которые трудно разделить. Вот почему микробный синтез с помощью коринебактерий и некоторых других микробов является ныне основным и экономически выгодным. Первое место здесь по праву занимает Япония, где лишь глутаминовой кислоты изготав- ливается свыше 100 тыс. тонн в год; большинство природных незаменимых аминокислот производит фирма "Такеда". С. Кино- шита, впервые в 50-е годы открывший и доказавший перспектив- ность микробного синтеза, уже в 1963 г. прогнозировал: "Мало сомнения в том, что недалеко то время, когда с помощью микро- организмов будет возможно производить все известные аминокис- лоты". Это время наступило уже к 70-м годам. Получены микробы — суперпродуценты из родов ВгеугЪас1епит, СогупеЪас4егшт, Мюгососсив и др., с помощью которых освоено крупнотоннажное
445
производство не только глутамата, но и 1,-лизина, Ь-валина, Ь-гис- тидина и других.
При суперпродукции уровень экспрессии клонированного гена выражается в синтезе специфического белка в количестве не менее 2% от всех растворимых белков клетки-хозяина. В настоящее время имеются суперпродуценты, у которых количество синтезируемого специфического белка достигает 10—50% (здесь важнейшую роль играют многокопийные плазмиды, несущие встроенные гены). Генно-инженерными методами во ВНИИ генетики и селекции промышленных микроорганизмов (Москва) был получен штамм Е.соН, обладающий сверхпродукцией Ь-треонина (30 г/л за 40 часов ферментации).
С любым штаммом — продуцентом какой-либо аминокислоты необходимо внимательное и бережное обращение в целях поддер- жания ее в активном состоянии в течение длительного времени.
Технология получения аминокислот базируется на принципах ферментации продуцентов и выделении вторичных метаболитов, то есть размножают маточную культуру вначале на агаризованной среде в пробирках, затем — на жидкой среде в колбах, инокуля- торах и посевных аппаратах, а затем в головных (основных) ферментаторах. Отработку культуральных жидкостей и выделение аминокислот проводят по схеме, аналогичной схеме получения антибиотиков (см.). Изолированные чистые кристаллы целевого продукта обычно высушивают под вакуумом и упаковывают.
Если аминокислота предусмотрена в качестве добавки к кор- мам, то биотехнологический процесс кормового продукта включает следующие стадии: ферментацию, стабилизацию аминокислоты в культуральной жидкости перед упариванием, вакуум-упаривание, стандартизацию упаренного раствора при добавлении наполните- ля, высушивание и упаковку готового продукта, в котором должно содержаться не более 10% основного вещества. Например, в про- мышленности изготавливают сухой кормовой и жидкий кормовой концентраты лизина наряду с кристаллическим лизином (рис. 136).
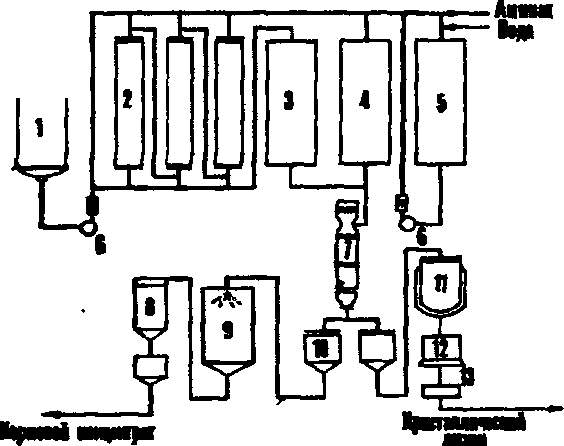
Рис. 136. Технологическая схема пол- учения лизина: 1 — емкость для культу- ральной жидкости (КЖ), 2 — ионообмен- ные колонны, 3 — сборник элюата, 4 — сборник фильтрата, 5 — емкость для элю- ата, 6 — насос, 7 — вакуум-выпарной аппарат, 8 — циклон, 9 — сушилка кор- мового концентрата, 10 — сборник, 11 — реактор-кристаллизатор, 12—центрифу- га, 13 — сушилка. 446
Если концентрат содержит 70-^-80% • сухих веществ, то он достаточно устойчив против микробной порчи за счет повышенной осмотической концентрации ингредиентов.
Известны два способа получения аминокислот: одноступенча- тый и двухступенчатый. Согласно первому способу, например, мутантный полиауксотрофный штамм — продуцент аминокислоты культивируют на оптимальной для биосинтеза среде. Целевой продукт накапливается в культуральной жидкости, из которой его выделяют согласно схеме на рис. 137.
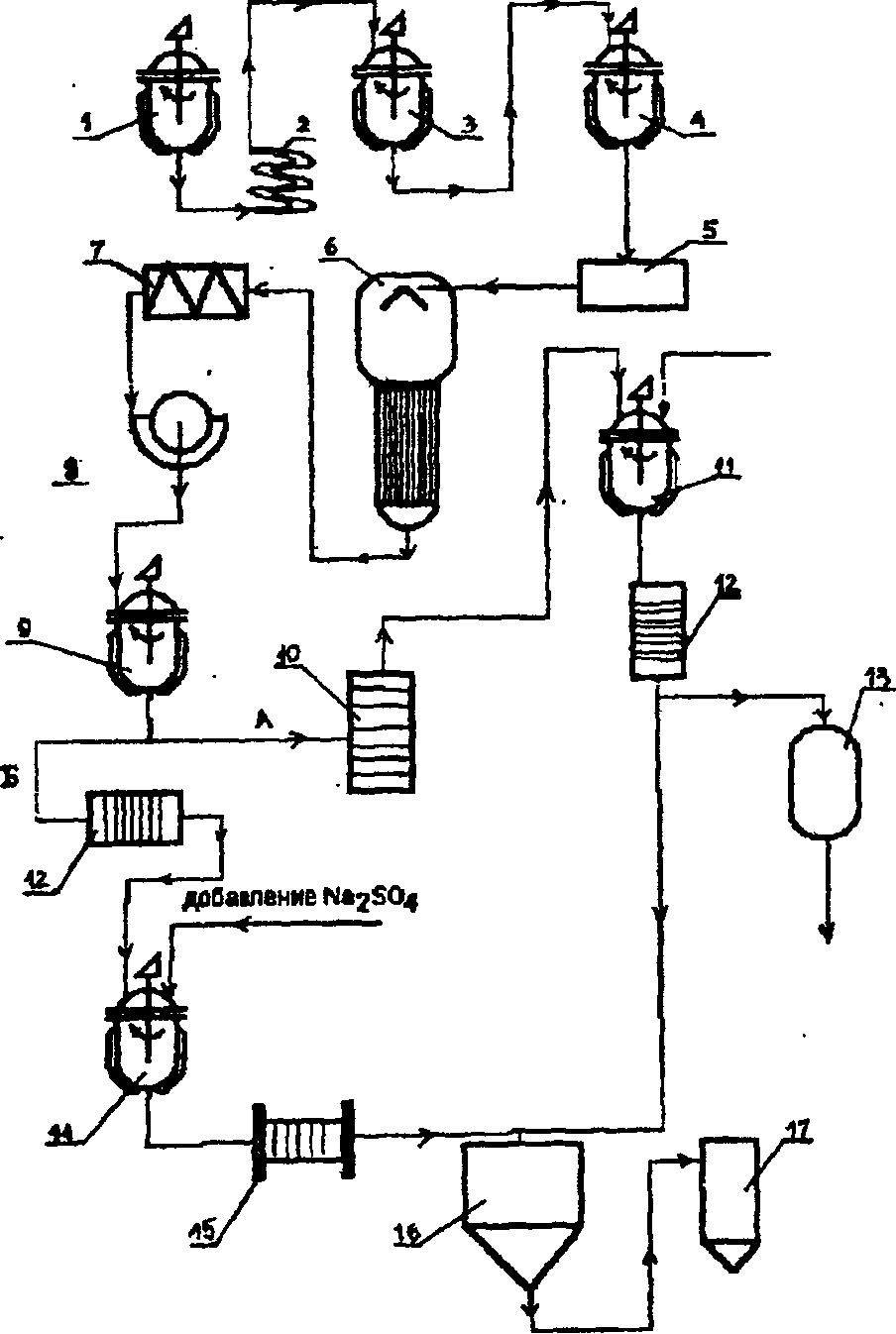
Рис. 137. При- мерная технологи- ческая схема пол- учения ферментов:
I — ферментатор, 2
охладитель, 3, 9
рефрижерато- ры, 4 — емкость для предварительной обработки, 5 — центрифуга, 6 — вакуум - упарива- тель, 7 — аппарат прямой предобра- ботки фермента, 8
— барабанный фильтр, А, Б—пути (при необходимо- сти смыкающиеся), 10 — аппарат для ультрафильтрации,
II — емкость для консервации рас- твора фермента, 12
— мембранный фильтр, 13 — нако- питель жидкого концентрата, 14 — емкость для осаж- дения фермента, 15 —фильтр-пресс, 16
— распылительная сушилка, 17 — на- копитель сухого концентрата.
В двухступенчатом способе микроб^продуцент культивируют в среде, где он получает и синтезирует все необходимые ингредиен- ты для последующего синтеза (в идиофазу) целевого продукта. Схема двухступенчатого процесса может быть представлена в следующем виде:
Микроб — продуцент аминокислоты
Т ступень
культивирование в жидкой питательной среде
Биосинтез предшественников аминокислоты и ферментов, катализирующих биосинтез целевого продукта
II ступень
биосинтез целевого продукта с участием ферментов
* Аминокислота — целевой продукт
Если ферменты биосинтеза аминокислоты накапливаются внутриклеточно, то после 1-й ступени клетки сепарируют, дезин- тегрируют и применяют клеточный сок. В других случаях для целей биосинтеза целевых продуктов применяют непосредственно клет- ки.
Экономически целесообразными являются способы получения аминокислот с помощью иммобилизованных ферментов и клеток. Сравнительно давно реализован процесс получения Ь-аспарагино- вой кислоты из фумаровой и аммиака в одну стадию с помощью иммобилизованных клеток Е.соп или Рвеисютопав аегидтова, об- ладающих аспартазной активностью (Е):
мн2
не—соон |
Н , пн-»—-—**• ноос—сн2-—сн— соон
ноос—сн л
фумаровая тслога аспаралют шелеп
Аспартаза катализирует реакцию присоединения аммиака к фумаровой кислоте. Фермент в иммобилизованном состоянии сохраняет активность на исходном уровне до 2—2,5 недель и более.
Ь-Аспарагиновую кислоту можно получить и с помощью иммо- билизованных клеток, что существенно повышает длительность функционирования системы, производительность которой по це- левому продукту составляет около 2000 кг с 1 м3 биореактора.
Периодические ферментации используют при получении дру- гих 1,-аминокислот (глутаминовой, фенилаланина, лизина, трипто-
фана и др.). При этом культивируют обычно специальные мутан- тные штаммы, метаболизм которых по целевому продукту изучен достаточно полно. Так, например, установлено, что лимитирующим агентом коринебактерий, образующих глутаминовую кислоту, яв- ляется биотин (витамин В?, витамин Н) в дозе 1—5 мкг/л. Биотин индуцирует структурно-функциональные изменения в клеточной мембране, благодаря чему увеличивается ее проницаемость для глутаминовой кислоты, выходящей из клетки в культуральную жидкость. Отдельные штаммы продуцентов способны накапливать ее более 50 г/л на мелассных средах.
Роль биотина аналогична в случае получения Ь-пролина, явля- ющегося производным Ь-глутаминовой кислоты.
9.3.5. Получение витаминов. Витамины поставляются в орга- низм с пищей или их назначают в форме лекарственных препара- тов при определенных патологических процессах. Среди липидо- и водорастворимых витаминов известны реализованные биотех- нологические процессы производства витаминов А| и ^, рибофла- вина, аскорбиновой кислоты, цианкобаламина (В12).
Каротиноиды — это изопреноидные соединения, синтезирую- щиеся многими пигментными микроорганизмами из рода А1еипа, В1акев1еа, СогупеЬас1епит, Р1ех1Ьас1ег, Ривагшт, На1оЬас1епит, РЬусотусев, Рвеисютопав, Кпосю1огша, Загста, 8рогоЬо1отусе8 и др. Всего описано около 500 каротиноидов.
Из одной молекулы З-каротина при гидролизе образуются две молекулы витамина А1. Это имеет место, например, в кишечнике человека.
1ч^М-сн=сн—1
/^СНз
с=сн—сн=сн—с=сн—сн2он
акмымнА1
Каротиноиды локализуются в виде сложных эфиров и глико- зидов в клеточной мембране микроорганизмов, либо в свободном состоянии — в липидных гранулах в цитоплазме. Каротиноид "ретиналь", например, у галофильного вида — На1оЬас1епшп Ьа1оЫшп — соединен с белком через остаток лизина (опсинопо- добный белок); он участвует в синтезе АТФ благодаря генерации трансмембранного потенциала. В целом, основная функция каро- тиноидов — защитная. Их биосинтезу в клетках способствует свет. 15 т. 8524 449
В качестве продуцентов каротиноидов можно использовать бактерии, дрожжи, мицелиальные грибы. Более часто применяют зигомицеты В1акев1еа глврога и СЬоаперЬога соп]'ипс1а. Спариваю- щиеся (+) и (—) особи этих видов при совместном культивирова- нии могут образовать 3—4 г каротина на 1 л среды.
Питательные среды для них достаточно сложные и включают источники углерода, азота, витаминов, микроэлементов, специаль- ных стимуляторов (гидрол, кукурузно-соевая мука, растительные масла, керосин, Р-ионон или изопреновые димеры, и пр.). Стиму- ляторы целесообразно вносить в культуральные среды в конце трофофазы, то есть когда продуцент переходит в продуктивную фазу (идиофазу).
Вначале штаммы выращивают раздельно, а затем — совместно при 26°С и усиленной аэрации с последующим переносом в основной ферментатор. Условия культивирования сохраняют прежними. Длительность ферментации — 6—7 дней. Каротиноиды извлекают ацетоном (можно каким-либо другим полярным раство- рителем), переводят в неполярный растворитель. В случаях извле- чения белково-каротиноидных комплексов, то применяют повер- хностно-активные вещества в концентрации 1—2%. В целях очи- стки и более тонкого разделения гомологов можно прибегать к методам хроматографии или к смене растворителей. Витамин А1 из 3-каротина сравнительно легко можно получить при гидролизе.
В случае изготовления каротинсодержащей биомассы для скар- мливания животным и птицам возможно ее сочетанное примене- ние с витамином А или без него. В медицинских целях витамин А изготавливают в капсулах для приема через рот.
Витамин Г> — это группа родственных соединений, в основе которых находится эргостерин, который обнаружен в клеточных мембранах эукариот. Поэтому, например, пекарские или пивные дрожжи применяют для получения эргостерина, как провитамина, обладающего антирахитическим действием. Содержание эргосте- рина в дрожжевых клетках колеблется в пределах 0,2—11%.
При недостатке в организме гормона 1,25-дигидроксихолекаль- циферола, предшественником которого является витамин Б3, у детей развивается рахит (аналог рахита у взрослых — остеомаля- ция).
Трансформация эргостерина в витамин Б2 (кальциферол) про- исходит под влиянием ультрафиолетового облучения. При этом разрывается связь в кольце (позиции 9,10) и образуется двойная связь в боковой цепочке (позиции 22, 23). Эта последняя гидриро-
450
вана в витамине Оэ (холекальциферол). Физиологическая актив- ность обоих витаминов (02 и Оэ) равноценна.
Кроме дрожжей продуцентами эрогостерина могут быть мице- лиальные грибы — аспергиллы и пенициллы, в которых содержится 1,2—2,2% эргостерина. Замечено, что полиеновые антибиотики, действующие на клеточную мембрану дрожжей, заметно стимули- руют их содержание в биомассе.
Получение эргостерина в производственных условиях можно подразделить на следующие этапы: размножения исходной куль- туры и накопление инокулюма, ферментация, сепарирование кле- ток, облучение клеток ультрафиолетовыми лучами, высушивание и упаковка целевого продукта.
Так, применительно к дрожжам, инокулюм получают на средах, обеспечивающих полноценное развитие клеток, после чего основ- ную среду с ацетатом (активатором биосинтеза стеринов), обога- щенную источником углерода и содержащую пониженное коли- чество азота (высокое значение С/1Ч[), засевают сравнительно большим объемом инокулята: Культивирование дрожжей (фермен- тацию) проводят при температуре, близкой к максимальной для конкретного штамма, и выраженной аэрации (2% 02 в газовой фазе). Спустя 3—4 суток, в зависимости от ростовых характеристик и биосинтетической активности культуры, клетки сепарируют и подвергают вакуум-высушиванию. Затем сухие дрожжи облучают ультрафиолетовыми лучами — УФЛ (длина волны 280—300 нм) в течение оптимального по продолжительности времени, при требу- емой температуре и с учетом примесных веществ. Эти контроли- руемые показатели, установленные опытным путем, указываются в регламентной документации. Облучение дрожжей можно прово- дить до сепарирования клеток в тонком слое 5% суспензии, учи- тывая малую проникающую способность УФА
Облученные сухие дрожжи применяют в животноводстве; в промышленности их выпускают под названием "кормовые гидро- лизные дрожжи, обогащенные витамином П2". В таком препарате содержится не менее 46% сырого белка, незаменимые аминокис- лоты (лизин, метионин, триптофан) и 5000 МЕ витамина Б2 /г.
В случае получения кристаллического витамина ^ клетки продуцента гидролизуют соляной кислотой при 110°С, затем тем- пературу снижают до 75—78°С и добавляют этанол. Смесь фильт- руют при 10—15°С, оставшуюся после фильтрации массу промы- вают водой, высушивают, измельчают, нагревают до 78°С и дважды обрабатывают тройным объемом этанола. Спиртовые экстракты
объединяют и упаривают до 70%-го содержания сухих веществ. Полученный "липидный концентрат" обрабатывают раствором ед- кого натра. Эргостерин кристаллизуется из неомыленнной фрак- ции концентрата при 0"С. Его можно очистить повторными пере- кристаллизациями. Кристаллы высушивают, растворяют в серном эфире, облучают УФЛ, эфир отгоняют, раствор витамина Б2 кон- центрируют и кристаллизуют.
"Кислотный фильтрат" обычно упаривают до 50%-го содержа- ния сухих веществ и применяют как концентрат В-витаминов. Производят также масляный концентрат витамина Б2.
Рибофлавин, или витамин В2 — содержится в клетках различ- ных микроорганизмов, будучи коферментом в составе флавопро- теинов (прежде всего — соответствующих ферментов из класса оксидоредуктаз — ФМН, ФАД). Поэтому в качестве продуцентов рибофлавина (флавопротеинов) могут быть бактерии, дрожжи и нитчатые грибы. Однако наиболее заманчивыми являются те штам- мы, которые образуют на жидких средах 0,5 г и более рибофлавина в 1 л среды. К подобным организмам относятся АзЬЬуп доввурп, ЕгетогЪесшт азЪЪуп и СапйМа дшШегтопсШ. Учитывая изменчи- вость активных продуцентов названных видов по способности синтезировать витамин В2, необходим систематический поддержи- вающий отбор культур в процессе их эксплуатации на производ- стве. Обычно активные продуценты первых двух видов формируют яркооранжевые колонии на агаризованных средах. Методами ген- ной инженерии удалось получить штамм сенной палочки, образу- ющий около 6 г рибофлавина в 1 л среды, включающей мелассу, белково-витаминный концентрат и его гидролизат.
Высокий выход рибофлавина у Е.азпЪуп коррелирует с азотом пуринов и другими азотистыми источниками, содержание которых должно быть достаточным. В качестве источников углерода при- меняют глюкозу или сахарозу, практикуют использование дрож- жевого и кукурузного экстрактов, соевой муки, масла (жира). Жидкие питательные среды для получения инокулюма и для основной ферментации могут несколько различаться между собой. Например, для получения посевного материала известна среда, содержащая сахарозу, пептон, кукурузный экстракт, калия дигид- рофосфат, магния сульфат, подсолнечное масло, время выращива- ния продуцента на этой среде — 2 суток при 27—30°С (в зависи- мости от штамма). Ферментационная среда обычно включает ку- курузную и соевую муку, сахарозу, кукурузный экстракт, калия
452
дигидрофосфат, кальция карбонат, натрия хлорид и ненасыщен- ный жир.
Обычно ферментацию проводят в течение 5 суток при рН 5,5— 7,7. После использования сахарозы (примерно через 30 часов) начинает заметно накапливаться витамин Вг, вначале — в мицелии, а затем — в культуральной жидкости. Всю биомассу можно подвергнуть высушиванию и полученный сухой продукт с остаточ- ной влажностью 8%, содержащий 1,5—2,5% рибофлавина, 20% белка, тиамин, никотиновую кислоту, пиридоксин, цианкобаламин, микроэлементы и другие вещества, рекомендуют для кормления животных.
В случае высоких выходных показателей по рибофлавину, витамин можно выделять в индивидуальном состоянии и, наряду с синтетическим рибофлавином, использовать в медицине.
Для СапсКёа дшШегтопсШ важно регулировать содержание железа в питательной среде; оптимальные концентрации колеб- лются, в среднем, от 0,005 до 0,05 мкг/мл. При этом определенные штаммы дрожжей могут образовывать за 5—7 дней до 0,5 г/л и более витамина. Однако для целей промышленного производства рибофлавина предпочитают использовать более продуктивные ви- ды и штаммы грибов — Е.азЬЬуп и АвЬЬуп доазурп.
 Аскорбиновая
кислота, или витамин С —
это противоцингот-
ный витамин,
имеющийся у.всех высших растений и
животных;
толькс человек и микробы
не синтезируют ее, но людям она
неотложно
необходима, а микробы не нуждаются в
ней. И, тем не
менее, определенные
виды уксуснокислых бактерий причастны
к
биосинтезу полупродукта этой
кислоты — 1,-сорбозы. Таким обра-
зом,
весь процесс получения аскорбиновой
кислоты явлйется
смешанным, то есть
химико-ферментативным.
Аскорбиновая
кислота, или витамин С —
это противоцингот-
ный витамин,
имеющийся у.всех высших растений и
животных;
толькс человек и микробы
не синтезируют ее, но людям она
неотложно
необходима, а микробы не нуждаются в
ней. И, тем не
менее, определенные
виды уксуснокислых бактерий причастны
к
биосинтезу полупродукта этой
кислоты — 1,-сорбозы. Таким обра-
зом,
весь процесс получения аскорбиновой
кислоты явлйется
смешанным, то есть
химико-ферментативным.
о
\. гиярировтие ОиоопоЬжЬг охуояпс
У »ИОНгС(СН0И)4СНгОН ■»
г 0-сорбиг биологическое окисление,
i рН-5,0
лимическии
процесс
»
нон/:со(снон)3сн,он ■>
(трансформация)
1*-сорбоза
Биологическая стадия процесса катализируется мембраносвя- занной полиолдегидрогеназой, а последняя (химическая) включает последовательно следующие этапы: конденсация сорбозы с диаце- тоном и получение диацетон — 1,-сорбозы, окисление диацетон — 1,-сорбозы до диацетон-2-кето-Ь-гулоновой кислоты, подвергаемой затем гидролизу с получением 2-кето-Ь-гулоновой кислоты; послед- нюю подвергают энолизации с последующей трасформацией в Ь-аскорбиновую кислоту.
Ферментацию Сохуёапв проводят на средах, содержащих сор- бит (20%), кукурузный или дрожжевой экстракт, при интенсивной аэрации (8—10 г Ог/л/ч). Выход Ь-сорбозы может достичь 98% за одни-двое суток. При достижении культурой 1од-фазы можно дополнительно внести в среду сорбит, доводя его концентрацию до 25%. Также установлено, что Сохуйапз может окислять и более высокие концентрации полиспирта (30—50%), создаваемые на последних стадиях процесса. Это происходит благодаря полиолде- гидрогеназы, содержащейся в клеточной биомассе. Ферментацию бактерий проводят в периодическом или непрерывном режиме. Принципиально доказана возможность получения Ь-сорбозы из сорбита с помощью иммобилизованных клеток в ПААГ.
Аскорбиновую кислоту используют как антиоксидант в здра- воохранении и пищевой промышленности.
Цианкобаламин, или витамин В12— получают только микроби- ологическим синтезом. Его продуцентами являются прокариоты и, прежде всего, пропионовые бактерии, которые и в естественных условиях образуют этот витамин. Мутанты РгорютЬас1епит впегтапИ М-82 и Рвеисютопав йетггШсапв М-2436 продуцируют на жидкой среде до 58—59 мг/л цианкобаламина.
Учитывая важную функцию витамина в организме человека (он является противоанемическим фактором), его мировое произ- водство достигло 10 т в год, из которых 6,5 т расходуют на медицинские нужды, а 3,5 т — в животноводстве.
Отечественное производство цианкобаламина базируется на использовании культуры Р.ггеийепгекЬп уаг. впегтапи, культиви- руемой в периодическом режиме без доступа кислорода. Фермен- тационная среда обычно содержит глюкозу, кукурузный экстракт, соли аммония и кобальта, рН около 7,0 поддерживают добавлением рЛ-ЦОН; продолжительность ферментации 6 суток; через 3 суток в среду добавляют 5,6-диметилбензимидазол — предшественник ви- тамина В12 и продолжают ферментацию еще 3 суток. Цианкобала- мин накапливается в клетках бактерий, поэтому операции по
454
выделению витамина заключаются в следующем: сепарирование клеток, экстрагирование водой при рН 4,5—5,0 и температуре 85—90°С, в присутствии стабилизатора (0,25% раствор натрия нитрита). Эксгрёштия протекает в течение часа, после чего водный раствор охлаждают, нейтрализуют раствором едкого натра, добав- ляют коагулянты белка — хлорид железа трехвалентного и алю- миния сульфат с последующим фильтрованием. Фильтрат упари- вают и дополнительно очищают, используя методы ионного обмена и хроматографии, после чего проводят кристаллизацию витамина при 3—4°С из водно-ацетонового раствора.
Кристаллический цианкобаламин можно получать с помощью резорцина или фенола, образующих с ним аддукты, которые сравнительно легко разлагаются на составляющие компоненты.
При реализации данного биотехнологического процесса не забывать о высокой светочувствительности витамина В^, поэтому все операции необходимо проводить в затемненных условиях (или при красном свете).
На ацетонобутиловой и спиртовой бардах с добавлением солей кобальта и метанола в нашей стране получают кормовой препарат КМБ и — концентрат, содержащий витамин В12 и другие ростовые вещества. Биообъектом здесь является смешанная культура мета- ногенных бактерий.
9.3.6. Получение микробных препаратов — удобрителей почв, стимуляторов и регуляторов роста растений. На основании более чем векового изучения азотфиксирующих микроорганизмов ут- вердилось представление о целесообразности производства в про- мышленных масштабах лишь клубеньковых бактерий, поскольку эффективность от внесения в почву препаратов из свободноживу- щих азотфиксаторов по разным причинам является незначитель- ной. Однако ясно, что в условиях интенсивного земледелия и бурного роста населения земли плодородие почвы — одна из главнейших проблем, на решение которой должны быть направ- лены усилия различных специалистов, включая биотехнологов. И нельзя считать, что свободноживущие азотфиксаторы не будут вновь объектами биотехнологии. Очевидно не все изучено приме- нительно к их ассоциативным взаимоотношениям в среде обитания и значение самой среды, заметно изменяющейся при энергичном воздействии на нее человека.
Микроорганизмы, фиксирующие азот из воздуха, подразделя- ют на свободноживущие в природных условиях и на симбйотиче- ские с растениями или другими микробами. К свободноживущим
455
относят азотобактеры, актиномицеты, определенные цианобакте- рии и др., к микробам-симбионтам: азотоспириллы — симбионты папоротника азолла, ризобии — симбионты бобовых растений, отдельные виды цианобактерии в составе лишайников (лишайники представляют собой пример устойчивого симбиоза некоторых грибов с цианобактериями или водорослями), и др.
Микробы-азотофиксаторы ежегодно фиксируют примерно 17,5* 107 т молекулярного азота из воздуха, из которых 10—15% приходится на цианобактерии. Очевидно, что до тех пор, пока не будут созданы "молекулярные гибриды" микробов — азотофикса- торов с широким набором полезных растений методами генной инженерии, использование соответствующих "препаратов-удобри- телей" будет целесообразным и экономически оправданным.
В таком же ряду находятся микробные стимуляторы и регуля- торы роста растений — гиббереллины, фузикокцин и др.
Ризотрофин — своеобразный "потомок" коммерческого пре- парата "нитрагин", впервые созданного в 1896 г. в Германии. Он представляет собой торфяную основу, смешанную с ризобактери- ями (5—8'Ю9 клеток в 1 г торфа). Производство ризотрофина разработано во ВНИИ сельскохозяйственной микробиологии (г. Санкт-Петербург).
Технологический процесс производства ризотрофина включает подготовку клубеньковых бактерий и получение инокулята, подго- товку торфа, "обсеменение" торфа ризобактериями (отбор видов' с учетом целесообразных рекомендаций по выращиванию соответ- ствующих растений-"хозяев").
В производстве используют клубеньковые бактерии, быстро или сравнительно медленно размножающиеся на простых средах, содержащих растительные экстракты или отвары, сахарозу (рН 6,8—7,0) — для первых, почти то же самое — для вторых, но добавляют глюкозу, маннит, сахарозу.
Инокулюм готовят в условиях умеренной аэрации на подобных средах, но дополнительно вводят неорганические соли: фосфаты, сульфаты, карбонаты (температура 28—30°С); необходимо пенога- шение. Накапливают примерно 5 млрд. клеток в 1 мл. Такую суспензию вносят в "кислый" торф (рН 3,0—6,0) при 10-15°С. Предпочтительнее использовать древесно-осоковые или осоковые торфа с удельной площадью поверхности порядка 300 м2/г.
Торф до "обсеменения" бактериями должен быть специально подготовленным —гомогенным, подсушенным, размолотым, ув- лажненным, смешанным с мелом, расфасованным в полиэтилено-
« 456
вые пакеты по 150—160 г и простерилизованным методом радиа- ционного облучения — 2,5 Мрад. В подготовленный торф "инъе- цируют" 50-60 мл суспензии бактерий (в торфе должно содержать- ся 0,5—1 млрд. клеток/г). После этого содержимое пакетов пере- мешивают во вращающемся барабане и продукт сохраняют до полугода при 5—10°С — применительно к быстро растущим ризо- бактериям и при 12—15°С — применительно к медленно растущим ризобактериям. Расход ризотрофина — 200 г на гектарную норму семян любых бобовых растений.
В странах Юго-Восточной Азии используют цианобактерии АпаЬоепа ахопае, обитающие в полостях листьев папоротника А/оЦа. Азоллу выращивают в специальных прудах, откуда ее вывозят по назначению. Такая симбиотическая ассоциация — хороший "удобритель" азотом рисовых полей.
В последние годы много внимания уделяют бактериям рода Азозршпшп — активному азотофиксатору, обитающему в почве (реже — на надземной части растений) в ассоциации с кукурузой, просом, сахарным тростником и др.
Гибберелловая кислота — синтезируется микромицетом СлЪЪегеИа 1и;ркиго1 (ее несовершенная форма Ризагшт топШюгте); она в качестве равноправного члена находится в ряду гиббереллинов А1..., А—группы растительных гормонов сложного химического строения, ядром которых является тетракарбоциклич- ный гиббан. Его образование представляет собой частный случай биосинтеза терпенов, как и синтез каротинов и витамина V.
 мн4он ^о-о
н
мн4он ^о-о
н
гибберелловая кислота
Все известные гиббереллины во многом сходны с гибберелло- вой кислотой и в зависимости от условий культивирования проду- цента могут варьировать в той или иной степени.
Биосинтез гибберелловой кислоты происходит, начиная с аце- тата и двух молекул АцКоА через ряд промежуточных продуктов, в том числе — через мевалоновую кислоту, изопентенилпирофос- фат и цикли зованные структуры. Образование и накопление гиб- береллинов — процесс длительный, он занимает до 15 суток и более
при поверхностном выращивании продуцента при 25°С, до 9—10 суток — при глубинных ферментациях. Питательные среды для С.ги]1киго1 обычно содержат 4—6% источника углерода (глюкозу, сахарозу или глицерин), 0,7% источника азота (соли аммония, нитрат или пептон), 0,3% неорганического фосфата, 0,05% магния сульфата, микроэлементы, особенно — железо, медь, марганец, молибден, серу, цинк; рН среды устанавливают на уровне 3,0—4,0 соляной кислотой. Выход гиббереллинов при этом достигает 200 мг/л культуральной жидкости (поверхностный способ) или 1 г/л (глубинное культивирование в ферментаторах).
С учетом близости структур гиббереллинов гибберелловую кислоту получают в виде суммарного препарата из вакуум-упарен- ной культуральной жидкости после отделения мицелия продуцента.
Гибберелловую кислоту применяют в сельском хозяйстве в качестве стимулятора роста различных растений с максимальным эффектом в дозе 1 мкг на растение.
Фузикокцин — относят к регуляторам роста растений гормо- нального типа. Он индуцирует корнеобразование у многих древес- ных и плодовоягодных культур, стимулирует прорастание семян моркови, томатов, сахарной свеклы и других сельскохозяйствен- ных растений (Г. С. Муромцев, 1986).
По Химическому строению фузикокцин относят к карботри- циклическим дитерпенам, в которых тройной цикл является агли- коном в гликозидной структуре.
сн»
. н3сосонгс
снг=сн—с—р-с(н2 -I
сн,—сн
 сн,
сн,
^ >°—:—Г 1
снгОсосн3
. \ ^
фузикокцин _ сн3
Фузикокцин образуется грибом Ризкгосспв атудёаи. Продукт получают при глубинной ферментации в периодическом режиме на средах с глюкозой или сахарозой и соевой мукой; фузикокцин затем экстрагируют бутилацетатом или хлороформом из культу- ральной жидкости, сорбируют активированным углем, повторно очищают и кристаллизуют из этилацетата.
В настоящее время активно изучают грибы Во1гуи8 стегеа и Сегсозрога го81Со1а — продуценты фитогормона — абсцизовой
458
кислоты, а также некоторые виды рода С1аёо8рогшт — продуцен- ты фитогормона котиленина, которые, очевидно, в скором времени будут производить в виде коммерческих препаратов.
![]()
абсцизовая кис/юта

котиленин
9.3.7. Получение микробных полимеров. Биотехнологические процессы получения микробных полимеров освоены в различных масштабах применительно к белкам, углеводам, липидам и неко- торым полимерным конъюгатам.
Получение белков. Белки микробного происхождения находят применение в здравоохранении, пищевой промышленности, жи- вотноводстве, реже — в других отраслях производства. Разнонап- равленность практического применения зависит от химической структуры, молекулярной массы и физико-химических свойств белков.
Ферментные белки, ферменты, будучи биокатализа- торами реакций в любом организме, давно приобрели важное практическое значение. Первый патент на грибную амилазу (та- кадиастазу) зарегистрировал И. Такамине в 1894 г. К настоящему времени описано свыше 3000 ферментов, из которых лишь немно- гие изготавливают в промышленности, то есть резерв здесь для биотехнологии поистине огромен.
В качестве лекарственных средств применяют гидролазы: гиа- луронидазу (она может быть микробного и животного происхож- дения, например, лидаза), протеазы, липазы, амилазу, из других классов — Ь-аспарагиназу, стрептазу в составе препарата стрепто- деказы, стрептокиназу и др.
В хлебопекарной и текстильной промышленности применяют амилазы, в мясо-молочной и кожевенной промышленности —■ пептидазы; в сельском хозяйстве используют такие полифермент-
ные препараты, как глюкаваморин, пектаваморин и др. Большое количество ферментов приходится на моющие средства.
Рестрикционные эндонуклеазы — важнейший "инструмент" для выполнения генно-инженерных работ. Часть производимых рестриктаз приведена в таблице 20.
К началу 90-х годов текущего столетия объем продажи фермен- тов на мировом рынке оценивали в сумме около 200 млн. долларов в год с ежегодным возрастанием на 10—15%. Лишь зарубежные фирмы производили свыше 200 наименований ферментных пре- паратов, в странах СНГ — около 40; примерно 40—50% мировой потребности в ферментах обеспечивается датской фирмой "Ново индастра".
В клетках микроорганизмов найдено порядка 1500 различных ферментов, причем в каждой клетке, по расчетам, содержится в среднем 100 тыс. молекул ферментов; на единичный энзим прихо- дится 0,1—5% от общего количества белка. ^
В сравнительном плане получение экзоферментов осуществля- ется с меньшими затратами усилий и средств, чем получение эндоферментов. В то же время успехи в области генетической инженерии явились мотивом к расширению ассортимента произ- водимых ферментов, в том числе :— для научных целей (пример с рестриктазами).
За последние 40 лет почти все новые ферментные препараты получены с помощью микроорганизмов, что объясняется быстро- той размножения большинства микробов на доступных и относи- тельно дешевых питательных средах, а также возможностью их изменения в желаемом направлении с помощью методов генети- ческой инженерии — созданы предпосылки трансформировать любой клеточный белок во внеклеточный.
Ферменты и ферментные системы могут функционировать ш лпЪго, однако их источником являются живые организмы, содержа- щие генетическую программу о синтезе первичных метаболитов, или ферментов. Поэтому вид микроба накладывает отпечаток на характеристику биокатализатора. Так, например, бактерии-термо- филы синтезируют ферменты, которые будут эффективны при повышенных температурах скорее, чем ферменты психрофилов. В любом случае для производства важны продуцент и образуемый им фермент (целевой продукт), о которых следует иметь представ- ление в возможно полном объеме.
Промышленный штамм должен быть апатогенным (кроме спе- циальных случаев), образовывать в больших количествах преиму-
460
щественно один фермент и минимум—других, если не преследуют цель получать ферментный комплекс; желательно, чтобы такой штамм не продуцировал аллергенные и токсические субстанции, и, наконец, хорошо развивался в крупномасштабных ферментато- рах.
На каждой стадии процесса ферментации необходимо контро- лировать чистоту культуры — продуцента и скорость его размно- жения, рН среды, отсутствие фаголизиса и выход фермента. Установлено, что одна жизнеспособная спора микроба-контами- нанта способна "заразить" объем среды, равный 10—50 м3. Поэтому важно убедиться в "монолитности" инокулята и в полной стериль- ности подготовленного к засеву ферментатора. К сожалению, в промышленных биореакторах трудно добиться абсолютно полной стерильности, поэтому целесообразно засевать питательную среду в них большим по объему и физиологически активным посевным материалом. Таким приемом обеспечивают конкурентоспособ- ность продуцента при возможном попадании в среду его обитания любого постороннего микроба. Этому же способствует уменьше- ние числа фаз размножения продуцента, если основной фермен- татор засевают культурой, находящейся в продуктивной фазе.
Так же как и в других биотехнологических процессах здесь предусматривают выращивание продуцента по схеме: лиофилизи- рованная стандартная культура —» рост в колбах на качалке до юд-фазы —» перенос инокулята в ферментаторы малой емкости (300—500 л) — инокуляторы —>• инокулят через 10—80 часов (в зависимости от процесса) в сопЛ-фазе подают в промежуточный ферментатор — посевной аппарат емкостью от 3 до 5 м3 —» посевным материалом в стационарной фазе засевают головной (основной) ферментатор емкостью 50 м3. Среда в инокуляторе, посевном аппарате и головном ферментаторе, как правило, одно- типна. Если основной биореактор имеет объем 3—5 м3, то исклю- чают промежуточную фазу подготовки инокулята (посевного ма- териала) в посевном аппарате, то есть в таком случае этот аппарат является головным.
Микроорганизм-загрязнитель обычно выявляют при микроско- пии или культурально при высеве на агаризованные питательные среды; бактериофаги обнаруживаются на основании замедленного роста продуцента и, как следствие, по снижению его продуктив- ности; рН среды контролируют с помощью рН-метров.
461
В производственных условиях ферменты обычно получают в периодических режимах культивирования продуцентов. Основная ферментация может продолжаться от одних до семи суток в зависимости от микроба и фермента. Примерная биотехнологиче- ская схема получения ферментов показана на рис. 137.
Перед завершением ферментации культуральную жидкость быстро охлаждают до +5°С, при необходимости доводят рН до требуемого показателя; предварительная обработка жидкости мо- жет заключаться в добавлении флокулянтов при последующих центрифугировании и вакуум-упаривании (при температуре ниже 35°С). После этого к упаренному центрифугату добавляют раствор электролита, чтобы освободиться от возможных загрязнителей (часть клеток продуцента, крупные частицы из среды, не отделив- шиеся при центрифугировании). Раствор затем фильтруют на вакуум-барабанном фильтре с намывным слоем, фильтрат посту- пает в рефрижератор, из которого в одном случае (для получения жидкого концентрата фермента) его подвергают ультрафильтра- ции, консервируют, пропускают через мембранный фильтр и собирают в накопителе, откуда он поступает на фасовку (на схеме — путь А). В другом случае (на схеме — путь Б) из рефрижератора (позиция 9) раствор фермента пропускают через мембранный фильтр, добавляют к нему электролит, например, натрия сульфат, для высаливания ферментного белка, пропускают через фильтро- пресс. Фермент- собирают и смешивают с встречным потоком раствора концентрата того же фермента (путь А) с последующим высушиванием в вакуум-распылительной сушилке. Сухой экстракт собирают в накопителе, стандартизуют по активности и подают на расфасовку и упаковку.
Жидкий ферментный концентрат, при необходимости, разбав- ляют дистиллированной водой до требуемой активности, добавля- ют к нему стабилизаторы (натрия хлорид, бензоаты, сорбинаты) и передают на фасовку и упаковку. Из жидкого концентрата фермент может быть осажден спиртом или ацетоном (равно как и высолен электролитом), высушен, измельчен, смешан с наполнителем (на- трия хлоридом, декстринами, крахмалом) до требуемой активности и упакован.
Когда необходимо выделить фермент в более очищенном виде и без большинства примесных (ферментных и неферментных) полидисперсных белков, то в схему можно включить стадии диа- лиза и гель-хроматографии.
Фактически целевое назначение фермента предопределяет сте- пень его очистки — она должна быть более высокой в случае получения фермента как медицинского препарата.
центрифугирование
и
промывание клеток
Жидкость
(отход) <
Клетки
|
дезинтеграция клеток
Цитозоль
центрифугирование
"Обрывки"
клеток «
(отход)
Ферментный'супернатант
различные
методы очистки
Раствор фермента
Дезинтеграцию
клеток можно проводить различными
способа-
ми: обработкой соответствующими
ферментами-гидролазами, ме-
ханическим
разрушением и пр.
Обработку
супернатанта (надосадочной жидкости)
проводят с
целью освобождения от
нуклеиновых кислот (действие нуклеаза-
ми,
высокомолекулярными катионами-полиэтилениминами
и др.),
от других белков (хроматография).
Получение
очищенных эндоферментов — дело
дорогостоящее
и поэтому стремятся
их не выделять из клеток, а использовать
в
иммобилизованном виде нативные
клетки, способные осуществ-
лять
желаемые каталитические функции.
В
ближайшем будущем получение ряда
ферментных белков
потенциально
возможно с помощью рДНК-биотехнологии,
которая
ныне затрагивает практически
все сферы биотехнологии.
Важнейшим
направлением в реализации каталитических
фун-
кций биокатализаторов является
их иммобилизация,
что
обеспечи-
вает многократное
использование фермента, пролонгацию
его
стабильности в активной форме,
возможность применения в не-
463
прерывных биотехнологических процессах, исключение, попада- ния фермента в целевой продукт.
Иммобилизованные ферменты — это основа "инженерной энзимологии" — самостоятельной ветви биотехнологии, впервые оформившейся в 1971 г. Иммобилизация фермента — "это любое ограничение свободы движения белковых молекул (или их фраг- ментов!) в пространстве" (И. В. Березин, 1987).
В 3-й части книги частично представлен материал по иммоби- лизации ферментов. Здесь лишь перечислим отдельные примеры для промышленнозначимых биокатализаторов. Наипростейшим методом закрепления бактериальной глюкозоизомеразы было вза- имодействие фермента с ионообменным носителем, в частности, с ДЭАЭ-целлюлозой — удерживание фермента за счет ионного взаимодействия. Такой же способ иммобилизации был реализован в отношении грибной аминоацилазы (Ф), использующейся в про- мышленности для получения 1,-аминокислот из синтетических рацемических ацил — ЬЬ-аминокислот:
Ацил - Ы. — аминокислота—/-^-—» Ь — аминокислота + ацил — Р — амино —
кислота
Глюкозоизомеразу с определенным успехом иммобилизуют на окиси алюминия — адсорбционное взаимодействие. При этом могут быть иммобилизованы ощутимые количества ферментов.
Ковалентноевзаимодействие ферментного белка возможно на алкиламинированном стекле, на керамике и пр. Однако такая иммобилизация характеризуется снижением активности фермен- тов и их эффективности в работе.
Наипростейшим способом иммобилизации оказалось сохране- ние фермента внутри клеток продуцента. Так, прогревание стреп- томицета, образующего глюкозоизомеразу, при 60—80"С сопро- вождается отмиранием культуры наряду с избирательным разру- шением автолизинов. Глюкозоизомераза остается активной, а ста- билизированные таким образом клетки становятся проницаемыми для малых молекул.
Внутриклеточный фермент может быть ковалентно сшит и, следовательно, фиксирован с помощью ковалентного связывания глутаровым альдегидом.
Микробные клетки—продуценты ферментов и сами ферменты могут быть заключены в различные гелевые и волокнистые струк- туры, в микрокапсулы, липосомы.
464
4
4
Рис.
138. Биореакторы
I—V типов, используемых
в
инженерной энзимологии: I
-—
периодического действия
(1
—
биореактор, 2 — мешал-
ка, 3 —
иммобилизованный
фермент), II —
проточный с
перемешиванием (1
—
биоре-
актор, 2 — мешалка, 3 —
им-
мобилизованный фермент, 4
—
вход субстрата, 5 — выход
целевого
продукта), Ш — с
подвижным
ферментным
слоем, IV — со взвешенным

5
4—2
4 — слоем, V — с рециркуляцией
Я (для III—V: 1 — колонна, 2 —
иммобилизованный фер- мент, 3 — вход субстрата, 4 — выход целевого продукта, 5 — рециркуляция). Если профиль водного раствора субстрата распространяется (течет) равномерно по всему сечению аппарата, то такой реактор функционирует по "поршневому типу". При этом концентрация субстрата максимальна на входе в аппарат, а концентрация целе- вого продукта — на выходе из аппарата. Реактор IV типа напоми- нает хемостат для культивирования микробов (удобен для контроля рН, температуры). Если конечный продукт может выступать инги- битором фермента, то в подобных случаях удобна конструкция III, если же при определенных условиях ингибитором оказывается субстрат, то лучше использовать конструкцию I. В IV реакторе поток раствора субстрата должен быть таким, чтобы постоянно удерживать фермент во взвешенном состоянии и не уносить его с выходящим потоком раствора целевого продукта.
Крупномасштабное производство приходится в основном на такие гидролазы, как протеазы и гликозидазы. Различают три категории протеаз — сериновые, кислые и металлопротеазы. Пер- вые термостабильны, оптимум рН для них выше 8,0. Поэтому сериновые протеазы широко используют в моющих средствах. Основными продуцентами этих ферментов являются бациллы.
Кислые протеазы имеют рН-оптимум 1,5—3,7. Они полезны в изготовлении сыров. Их продуцируют, например, различные виды низших грибов (Мисог, ЕпйогЪеа и др.). Грибной реннин с успехом заменяет сычужный фермент из желудков телят. Однако необхо- димо подчеркнуть, что рекомендации использовать термофильный штамм вида Мисог рикШиз, образующего реннин, должны быть восприняты с большой осторожностью, поскольку из научной литературы и медицинской практики известно, что этот вид может вызывать заболевания у людей (мукороз, или мукоромикоз).
Металлопротеазы с оптимумом рН в нейтральной зоне (6,5—7,5) применяют в пищевой промышленности. Их основными продуцен- тами являются бациллы.
Из гликозидаз большое значение приобрели грибные и бакте- риальные амилазы, катализирующие реакции гидролиза крахмала. Сегодня в мире организовано крупнотоннажное производство глюкозо-фруктозных сиропов на основе эксплуатации иммобили- зованной глюкозоизомеразы, обеспечивающей превращение глю- козы во фруктозу (рис. 139). Фруктоза (левулеза) слаще глюкозы и такими сиропами заменяют сахарозу в соответствующих видах подслащенных или сладких изделий пищевых продуктов. Следует иметь в виду возможность получения фруктозных сиропов из жидких отходов в производстве декстрана, где до сих пор на заводах в странах СНГ фруктоза "уходит в трапы".
Пектиназы успешно применяют при изготовлении фруктовых соков. Эти ферменты включают комплекс индивидуальных биока- тализаторов: пектинлиаз, пектатлиаз и полигалактуронидаз (пек- тинэстераз). С их помощью осветляют и снижают вязкость соков
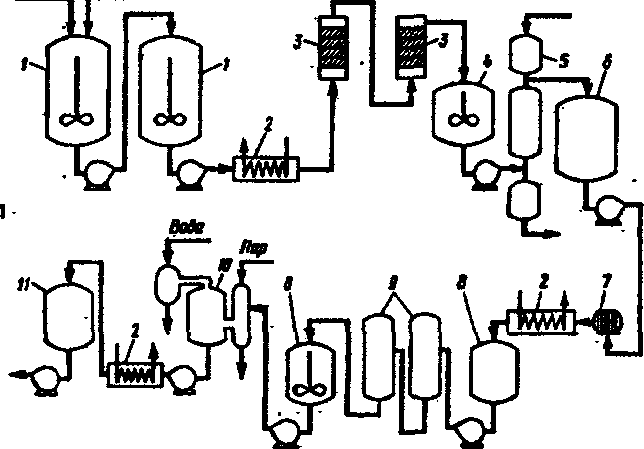
466
благодаря гидролизу пектина, что весьма важно при концентриро- вании соков. Основным продуцентом пектиназ является АярегдШив шдег.
 В
промышленных условиях производят и
другие ферменты,
названные в таблице
47.
В
промышленных условиях производят и
другие ферменты,
названные в таблице
47.
Другие белки и белковые продукты.
Токсины и анатоксины. Отдельные виды болезнетворных мик- роорганизмов образуют экзотоксины, которые могут быть отнесе- ны к "факторам агрессии". Они представляют собою высокополи- мерные термолабильные белки — продукты матричного синтеза, секретирующиеся в окружающую среду. При попадании в орга- низм человека экзотоксины вызывают серьезные повреждения функций определенных тканей или систем. Например, столбняч- ный токсин относят к числу нейротоксинов, нарушающих функ- цию нервно-мышечного аппарата; гангренозные токсины являются некротоксинами, индуцирующими повреждение тканей; экзоток- сины определенных штаммов кишечной палочки повреждают ки- шечник и т. д. По механизму действия на ткани они сходны с ферментами. Некоторые токсины применяют для диагностики соответствующих заболеваний. Например, токсин дифтерийный рекомендуют для постановки внутрикожной реакции Шика. Ток- син изготавливают по обычной схеме выделения экзобелков из жидких питательных сред после выращивания определенных штаммов дифтерийных бактерий. Препарат для реакции Шика готовят из очищенного дифтерийного токсина, разводя его глице- рино-желатиновой смесью до необходимой концентрации (1/40 часть одной смертельной дозы для морских свинок — одна Шик- доза). Выпускаемый препарат — бесцветная прозрачная жидкость в ампулах по 1 мл. Срок годности — 2 года, хранят при 3—10СС.
Обработка экзотоксинов формалином сопровождается их пол- ным обезвреживанием при сохранении антигенных свойств. Обез- вреженные токсины называют анатоксинами, или токсоидами. Их используют для получения антитоксических сывороток (глобули- нов) . В практике здравоохранения находят применение следующие анатоксины: ботулинический, гангренозный, дифтерийный, стафи- лококковый, столбнячный.
Технология получения экзотоксинов включает следующие ста- дии: культивирование соответствующего штамма патогенного мик- роба-продуцента на определенной питательной среде и при опти- мальных режимах (рН, температура, аэрация или анаэробиоз, продолжительность выращивания), обезвреживание формалином при 37—40°С, сепарирование клеток (отход) от культуральной жидкости, содержащей анатоксин; очистка, концентрирование, добавление адсорбента, фасовка, упаковка.
В качестве адсорбентов обычно используют неорганические вещества — алюминия гидроксид, алюминия фосфат, кальция .
468
фосфат и т. п. (в России применяют гидроксид алюминия), которые создают депо в организме при введении анатоксинов. Таким образом, удается повысить эффективность иммунизации.
Очищенные адсорбированные анатоксины — это жидкие пре- параты-суспензии, расслаивающиеся на белый, светло-коричне- вый или желтоватый осадок и прозрачную надосадочную жид- кость.
Ботулинические и гангренозные анатоксины применяют для иммунизации лошадей в целях получения специфических лечеб- ных иммунопрепаратов.
Дифтерийный анатоксин рекомендуют в качестве профилак- тического антидифтерийного средства для активной иммунизации. Его выпускают в виде монопрепарата и в составе ассоциированных вакцин и в каждом из них токсин адсорбирован на гидроксиде алюминия. Монопрепарат— адсорбированный дифтерийный, или АД-анатоксин — представляет собой очищенный концентрирован- ный продукт, содержащий в 1 мл 60 антигенных (флоккулирующих) единиц анатоксина и не свыше 2 мг адсорбента. Флоккуляция — это реакция взаимодействия дифтерийного анатоксина или токси- на с антитоксином (иммунной сывороткой). Флоккулирующая единица — это минимальное количество антигена (токсина), обра- зующего флоккулят (от лат. Яоссиц — клочок).
АДС-анатоксин — это ассоциированный препарат из очищен- ных концентрированных дифтерийного и столбнячного анатокси- нов, адсорбированных на А1(ОН)3 и содержащих в 1 мл 60 анти- генных единиц дифтерийного анатоксина и 20 единиц (антиток- синсвязывающих) столбнячного анатоксина и не более 2 мг адсор- бента. Известен и другой вариант препарата с содержанием в 1 мл тех же ингредиентов в соотношении 1:1, адсорбент, как и в первом варианте.
АКДС-вакцина - ассоциированный препарат, включающий те же вещества, что и АДС-анатоксин, а также коклюшную вакцину. В 1 мл такой вакцины содержатся дифтерийный и столбнячный анатоксины по 30 и 10 антигенных единиц соответственно, не более 2 мг алюминия гидроксида и 20 млрд. клеток коклюшных бактерий, убитых формалином или мертиолатом. Мертиолат используют как консервант в концентрации 0,01%; в 0,5 мл вышеназванных пре- паратов содержится одна прививочная доза. Перед употреблением их необходимо взбалтывать. Форма выпуска— ампулы с 1 мл препарата. Хранят ампулы с АД- и АДС-анатоксинами при 3—10°С до 3 лет (срок повторного контроля и определения возможности
469
дальнейшего хранения еще в течение 1 года). Что касается АКДС- вакцины, то ее срок хранения в тех же условиях сокращается в 2 раза, т. е. до 1,5 лет с вероятностью продления его на 6 месяцев после переконтроля. Прививки делают согласно схеме, утвержден- ной МЗ России.
В 1994 г. в Канаде введена в практику пентавалентная вакцина против коклюша, дифтерии, столбняка, полиомиелита и заболева- ний, вызванных гемофильной палочкой серотипа Ъ(Н1Ь).
Дифтерийный анатоксин, как монопрепарат используется так- же для гипериммунизации лошадей в целях получения лечебной противодифтерийной сыворотки, содержащей антитоксический иммуноглобулин.
Профилактику столбняка осуществляют либо одним столбняч- ным анатоксином (20 ЕС в 1 мл с адсорбентом), либо в ассоциации с другими препаратами, в частности, его применяют в составе АДС-анатоксина и АКДС-вакцины (см. выше), а также в составе ТАВТе-вакцины — "химической" сорбированной тифо-паратифоз- но-столбнячной вакцины, содержащей по 0,2 мг брюшнотифозного и А-паратифозного, 0,25 мг В-паратифозного антигенов, 10 ЕС столбнячного анатоксина и 1,5—2 мг А1(ОН)3. Выпускают во фла- конах, содержащих 8 мл препарата для инъекций, и консервант мертиолат. Срок хранения — 3 года при 8—10°С (срок переконт- роля с возможностью хранения еще в течение 1 года). Иммуниза- цию людей проводят по схеме, утвержденной МЗ России.
Столбнячный анатоксин, реже — токсин используют для ги- периммунизации лошадей в целях изготовления противостолбняч- ной сыворотки, содержащей антитоксический иммуноглобулин. Иммунопрепарат используют в качестве лечебного и экстренно- профилактического средства.
Стафилококковый анатоксин представляет собой стерильный фильтрат бульонной культуры золотистого стафилококка, содер- жащий экзотоксин, обезвреженный формалином. Количество ток- сина в такой жидкости должно быть не менее 5 ЕС в 1 мл препарата; консервант не добавляют. В готовом виде нативный стафилокок- ковый анатоксин — прозрачная желтоватая жидкость для подкож- ного введения. Форма выпуска — ампулы по 2 мл. Из этого анатоксина получают очищенный адсорбированный анатоксин осаждением трихлоруксусной кислотой с последующей очисткой этанолом и адсорбцией на гидроксиде алюминия. В 1 мл препара- та-суспензии содержится 10 ЕС.
Токсические белки энтомопато генных бацилл.
Некоторые энтомопатогенные бациллы применяют в качестве биологических средств защиты и борьбы с вредными насекомыми (от греч. еп1отоп-насекомое). К их числу относят Вас. рорЦЦае и Вас. &иппдДеп818, образующих в процессе спорообразования так называемые параспоральные белковые кристаллы. Синтез такого белка находится под контролем промотора гена, содержащегося в плазмиде.
Вас. рорПИае способна вызывать хроническое инфекционное заболевание у насекомого, передающееся другим особям и распро- страняющееся среди популяции.
Вас. 1липпддеп818 токсический параспоральный белковый кри- сталл действует на вредных насекомых как пестицид. К сожалению, во внешней среде этот токсин длительно не сохраняется, поэтому требуются повторные обработки данной культурой территорий с вредными насекомыми.
Вас. рорННае и родственные ей микробы (Вас. 1епИтогЪи8, Вас. еиюотагпае и др.) индуцируют так называемую молочную болезнь у жуков-скарабеев. Эти виды бацилл трудно культивировать на искусственных питательных средах, но все же удается, если под- держивать анаэробные условия. Собирают спорулирующую массу, споры сепарируют, смешивают с наполнителем, фасуют и упако- вывают. Применяют в виде порошка - дуста. Споры Вас. рорйпае заглатываются личинками насекомых, прорастают в кишечнике и делятся, давая потомство. Бактерии попадают в гемолимфу и через 10 дней у насекомых возникают признаки молочной болезни. Клетки затем спорулируют, образуя к моменту гибели одной личинки порядка 5»109 спор.
Препарат на основе ВасрорИНае длительное время изготавли- вают в США в целях контроля численности японского жука— РорИпа ]'арошса.
В России изготавливают препараты (дендробациллин, инсек- тин, токсобактерин, энтобактерин-3 и др.) на основе Вас. 1лштпд1епз18. Данный вид микроба образует два токсина — Р и 6, из которых Р-экзотоксин обладает широким спектром действия на насекомых; он представляет собой адениннуклеотид, конкурентно ингибирующий ферменты, которые катализируют реакции гидро- лиза АТФ и пирофосфата.
При введении В-токсина млекопитающим животным он оказы- вается для них губительным. Поэтому в производстве используют штаммы, не продуцирующие Р-экзотоксин, но образующие 6-ток- син, который и представляет собой белковое кристаллическое вещество - "параспоральное тело" - правильный восьмигранник. Чтобы проявить токсичность, б-токсин должен попасть в кишечник личинок насекомых прежде всего - листогрызущих из отряда чешуекрылых Ьор1с1ор1ега), где растворяется в щелочной среде и частично гидролизуется протеазами. Такой модифицированный белок взаимодействует со стенкой кишки и изменяет ее так, что содержимое кишечного тракта попадает в кровоток, вызывая общий паралич. Смерть личинок наступает от септицемии.
6-Токсин безвреден для млекопитающих животных, человека, птиц. В литературе о Вас. 1пигтд1еп818 описано более 20 серотипов (сероваров) микроба и 15 вариантов 6-токсина, часть из которых имеет промышленное значение, например, 1пигтд1епз18 или Ьег1тег(1), а1е8й(Ш), с!епйгоНтиБ(1У), да11епа(У) и др.
Коммерческие препараты представляют собой сумму спор и белковых кристаллов в клетках микроба-продуцента.
Технология получения энтомопатогенных препаратов включает следующие стадии: 1) проверка маточной культуры на отсутствие свободного фага, продуктивность спор и кристаллов, на вирулен- тность; 2) выращивание культуры в колбах до титра спор не менее 1,7* 109 в 1 мл; 3) пересев культуры из колб в посевной аппарат (0,05% на объем среды); 4) засев посевным материалом основного ферментатора (вносят 0,0012% инокулюма от объема среды в биореакторе). Продолжительность выращивания в посевных и головных ферментаторах - 35-40 часов при 28-30°С (исходное значение рН 6,3) до получения указанной выше плотности спор в 1мл среды. В процессе культивирования среда защелачивается до рН 8, 0-8, 5, поэтому перед тем, как передать ее на сепарирование, рН доводят до 6,0-6,2 подкислением. После сепарирования получа- ют пасту (в среднем 100 кг из 1м3 культуральной жидкости) с влажностью 85% и содержанием спор 2 • 1010 в 1 г.
Готовый продукт может быть в виде стойкой вязкой жидкости кремового или светло-серого цвета, без запаха - она содержит наполнитель—кристаллическую микроцеллюлозу; другой вариант - смачивающий порошок, приготовленный после высушивания на распылительной сушилке (остаточная влажность 10%) и смешения с каолином. Концентрация спор в препаратах 3 • 109 в 1г.
472
Белки одноклеточных и многоклеточ- ных микроорганизмов
На белки приходится часть сухих веществ микробной клетки от 19 до 90% (таблица 48).
Таблица 48. Содержание белка (% от сухой массы) в клетках некоторых бактерий и грибов
Микроорганизм |
Бе- лок, % |
Микроогранизм |
Бе- лок, % |
А&регдШив Пауив |
19 |
КпосМогша гиЬга |
56 |
АарегдШив шдег |
33 |
Басспаготусев сеге^ие |
56 |
Шигорив шдпсапв |
36 |
5Ьер1отусев дпвеив |
57 |
РешсШшт поЬа1ит |
38 |
ВасШив виЫШв |
63 |
ВасШив теда1епит |
39 |
54арЬу1ососсив аигеив |
65 |
СагжВДа агЬогеа |
46 |
ЕвспепсЫа сои |
82 |
Ьас1оЬасШив саве! |
47 |
Сас(оЪасШив Гегтеп1апз |
87 |
СапсВДа иШ1а |
53 |
МеШапоЪас1епит ер. |
90 |
Напзепша 8иал«ео1еп$ |
53 |
|
|
Следовательно необходимо иметь в виду, что в случае исполь- зования микробной биомассы как белкового продукта, фактически имеют дело с суммой различных веществ (в том числе — небелко- вых, содержащихся в клетках). Не существует природных белков с эквимолярным количеством составляющих его аминокислот, но их (аминокислот) относительное содержание является строго оп- ределенным для каждого белка.
На практике чаще прибегают к использованию убитых клеток в качестве белкового продукта, так как любые методы выделения протеинов из клеточной биомассы сопровождаются незначитель- ным выходом целевого продукта.
473
В разные годы и в разных странах применяли следующие микроорганизмы как источники белка: БассЬаготусез сегелпзхае, Сапсййа иШаз, Ривапит дгаттеагит, Ме1лу1отопа8 с]ага, СапгИйа ТгоркаИз (апатогенные штаммы), СапсИёа таИоза, Нап8епи1а зр. и др. Выращивание производили и производят на различных средах, нередко используя отходы или Конечные продукты в других про- изводствах (деревообрабатывающей промышленности—сульфит- ные щелока, сельского хозяйства — меласса, гидролизаты соломы, кукурузных кочерыжек и пр., нефтеперерабатывающей промыш- ленности — н-алканы, Сц—Сш; спиртовой промышленности — этанол; газовой промышленности — метан).
Пивные дрожжи с разной интенсивностью стали использовать в пищу с конца XIX в., особенно — в периоды разрухи и недостатка пищевых продуктов, например, во времена первой и второй миро- вых войн. В 1980 г. в Англии был разрешен к использованию в пищу микопротеин — мицелий гриба Ризагщгя. дгагшпеагит, тек- стура которого удобна для включения различных наполнителей и формования, например, мясоподобных изделий.
Технология получения кормового или пищевого белка однокле- точных и многоклеточных микроорганизмов сравнительно неслож- ная и заключается в наращивании по возможности наибольшего количества биомассы клеток, ее денуклеинизации, сепарировании и приготовлении целевого продукта. Культивирование того или иного микроорганизма проводят в оптимальных условиях (до получения десятков-сотен граммов дрожжей в 1 л) в периодическом или непрерывном режиме, в стерильных или нестерильных усло- виях; денуклеинизацию клеточной биомассы можно проводить различными способами — экстракцией метанолом или щелочами, обработкой нуклеазами, температурным шоком для активизации эндонуклеаз (в частности — РНКазы); отделением белка от нукле- иновых кислот из дезинтеграта клеток. Повышенное количество нуклеиновых кислот в белке нежелательно из-за возможного повышения мочевой кислоты т ллуо и, как следствие, потенциаль- ное возрастание опасности заболеть подагрой и почечно-каменной болезнью (содержание нуклеиновых кислот в микробном протеине не должно превышать 2 г в сутки).
Известны различные коммерческие белковые продукты, изго- тавливаемые в промышленности тех или иных стран мира (таблица 49).
 Микробный
белок заманчив в перспективе, поскольку
его
экономическая целесообразность
представляется несомненной хо-
тя
бы из следующего сравнения: на 1 кг корма
для крупного
рогатого скота можно
получить около 70 г говядины с содержанием
14
г белка, тогда как на 1 кг углеводов с
добавкой неорганического
азота для
р. дгаттеагат в Англии получают около
1100 г. сырой
мицелиальной массы,
содержащей 136 г белка.
Микробный
белок заманчив в перспективе, поскольку
его
экономическая целесообразность
представляется несомненной хо-
тя
бы из следующего сравнения: на 1 кг корма
для крупного
рогатого скота можно
получить около 70 г говядины с содержанием
14
г белка, тогда как на 1 кг углеводов с
добавкой неорганического
азота для
р. дгаттеагат в Англии получают около
1100 г. сырой
мицелиальной массы,
содержащей 136 г белка.
Сепарирование клеток из культуральной жидкости проводят одним из следующих способов (в зависимости от биообъекта): фильтрованием через ротационные вакуум-фильтры, фильтр-прес- сы (например для отделения мицелиальной массы); коагуляцией или электрокоагуляцией с последующим центрифугированием, исключая фильтрацию (например, для отделения бактериальной массы); центрифугированием, используя центрифуги непрерывно- го действия, например, для дрожжей, или корзинчатые — для нитчатых грибов.
На последних стадиях отсепарированную клеточную массу можно подвергать либо высушиванию (не чрезмерному) различ- им
ными методами, либо подсушиванию, либо эффективному отжиму. В конечном продукте все клетки микроорганизмов должны быть погибшими. На рис. 128а показана принципиальная схема получе- ния кормовых дрожжей.
Получение микробных гликанов и гликоконъюгатов
Микробные полисахариды, или гликаны можно подразделить на внеклеточные и внутриклеточные, или экзо- и эндогликаны. Внутриклеточные могут быть структурными в клеточных стенках (нерастворимые хитин, глюканы) и структурно-метаболическими (относительно растворимые маннаны, гликоманнаны, определяю- щие антигенную специфичность видов), способными переходить в культуральную жидкость при гиперпродукции и оказываться в разряде внеклеточных. К эндогликанам относятся запасные утево- ды и различные гликокрнъюгаты (нуклеозиды и полинуклеотиды, отдельные ферменты, гликолипиды, пептидогликаны и др.).
Выраженными продуцентами экзогликанов являются молочно- кислые и уксуснокислые бактерии, ксантомонасы и псевдомонасы, отдельные виды дрожжевых и нитчатых грибов. В разных странах производят альгиновую кислоту с помощью А2о1оЬас1еглг1пе1апсШ, Рзеийоглопаз аегидтоза, аубазидан — с помощью АигеоЬазШшт риПшапз, декстран (продуценты — Ьеисопоз1ос тёзеМегоМез,
ёех1гатсит), курдлан (продуцент — А1саИдепез ГаесаИз уаг. пиходепез), маннаны (продуценты — разные дрожжи из родов Напзепи1а, Ктюс1о1оги1а и др.), пуллулан (продуцент — Аиге- оЬазхсУит ри11и1апз) и др.
Из эндогликанов (в виде гликоконъюгатов) на практике изве- стны: пирогенал, продигиозан, сальмозан, выделяемые из биомассы клеток следующих микроорганизмов соответственно: 5а1топе11а зрр., Зеггаиа тагсезсепз и 5а1топе11а гурЫ; мурамилпептиды из клеточных стенок грамположитёльных бактерий; некоторые гли- копротеины или пептидогликаны (их включают в состав иммуно- генных препаратов, например, пептидогликан из К1еЬз1е11а рпеитошае входит в состав рибосомальной вакцины "Рибомунил", выпускаемой во Франции).
Технологические процессы получения экзогликанов заметно различаются на стадии их выделения, очистки и высушивания. Это обусловлено неодинаковыми структурой и физико-химическими свойствами экзополисахаридов (молекулярная масса, раствори- мость, конфигурация гликозидных связей и пр.). Ферментацию продуцентов проводят в аэробных или анаэробных условиях, асеп- тично, в периодическом режиме, на средах с подходящими источ-
476
никами углерода и азота. В большинстве случаев стремятся под- держивать такие условия, когда соотношение С/Ы в среде больше 1, так как в противном случае микроорганизм будет находиться преимущественно в трофофазе без выраженной продукции экзог- ликана.
В конце ферментации, при .сметном накоплении полисахарида, культуральная среда может приобретать консистенцию геля. Если необходимо отделять клетки от гелеобразной культуральной жид- кости, то нередко прибегают к многократному ее разбавлению водой (иногда в 10—15 раз) в потоке перед подачей в сепаратор или в специальные емкости. При необходимости клетки продуцен- та убивают прогреванием до сепарирования. В некоторых случаях, например, при изготовлении полисахаридов медицинского назна- чения, сепарирование повторяют 2—3 раза.
Если экзополисахарид резко изменяет вязкостные характери- стики в водном растворе при подкислении и подщелачивании (без разрушения своей первичной структуры), то перед сепарировани- ем экзогликан разжижают добавлением соответствующего реаген- та (например, щелочи), сепарируют клетки продуцента без разбав- ления культуральной жидкости, а затем подкисляют раствор по- лисахарида (например, соляной кислотой), восстанавливающего при этом свои первоначальные свойства (курдлан).
Последующая стадия заключается в вакуум-упаривании или "мембранном" концентрировании, используя соответствующие фильтры типа "Владипор" или "Миллипор", с последующим осаж- дением экзогликана каким-либо полярным растворителем.
На последней стадии технологического процесса полученный экзогликан подвергают высушиванию, измельчению с последую- щей упаковкой в соответствующую тару, или используют его для приготовления коммерческого продукта (раствор для инъекций, гранулы для приема внутрь, гели косметические, пасты, кремы и пр.). В таких случаях возможен гидролиз полисахарида на какой- либо стадии технологического процесса в целях его деполимери- зации (декстран).
Эндогликаны выделяют из клеточной массы либо экстракцией соответствующими экстрагентами в водных или водно-спиртовых растворах, либо используют предварительный гидролиз клеток (ферментный, щелочной, кислотный) или дезинтеграцию в каких- либо дезинтеграторах, либо протопластирование (в случае выделе- ния небольших количеств целевого продукта).
477
Полученный тем или иным способом водный раствор эндогли- кана (гликоконъюгата) подвергается выделению и очистке таким же образом, как и экзогликаны.
Гликаны, выполняющие общебиологические защитные функ- ции в живых организмах на молекулярном и клеточном уровнях, находят широкое практическое применение в качестве основных и вспомогательных веществ: плазмозамещающие агенты (6% вод- ный раствор декстрана—полиглюкин), лекарственные (пирогенал, родэксман, продигиозан) и диагностические средства (см. раздел об антигенах и аллергенах), иммуноадьюванты (грибные полиса- хариды, сальмозан), гидрофильные основы для мазей, суспензий, кремов, паст и др. (аубазидан, декстран, пуллулан).
Ассортимент углеводных полимеров может быть расширен за счет изготовления на их основе полусинтетических производных, например, сульфатированных декстранов, маннанов и других гли- канов, относящихся к группе гепариноподобных веществ — гепа- риноидов.
Микробные липиды пока не внедрены в промышленное про- изводство, хотя некоторые продуценты являются заманчивыми для этих целей, поскольку могут накапливать липиды до 40% и более в расчете на сухие вещества клеток. К тому же в составе этих липидов содержатся биологически ценные ненасыщенные жирные кислоты. К таким продуцентам могут быть отнесены: Сгур1ососсиз 1етсо1из, Ыротусев Црокэгиз, Кпос1о1оги]а дгасШв, ЗрогоЪоютусез гозеиз, ТпсЬозрогоп риШЛапз и др. На первых порах перспективно использование "липидных дрожжей" в качестве кормовых добавок, особенно -— тех их них, которые синтезируют также заметные количества и витаминов (например, каротина).
Получение полиоксибутирата
Поли В(-)Р-оксимасляная кислота — это запасной энергетиче- ский материал у прокариот с ММ от 60 кДа до 250 кДа. В отсутствии экзогенного источника энергии он деполимеризуется и участвует в снабжении клетки АТФ.
Полиоксибутират накапливается в клетках (иногда до 70% от сухих веществ) в форме гранул диаметром 0,1—0,7 нм, окруженных мембраной. По своим физико-химическим свойствам он перспек- тивен в радиоэлектронике (обладает хорошими пьезоэлектриче- скими свойствами), в медицине (хирургический материал), фарма- ции (вспомогательное средство при создании некоторых лекарст- венных форм), в органическом синтезе (сходен с полиизопропи-
478
леном по термопластическим характеристикам, Iе плавления 166— 188°С).
НО—СН—СН,—СО-
СН,
-О—СН—СН,—СО- СН,
-О—сн—си2—соон
СН,
попиоксибутират (1^300-1300)
Заметные количества полиоксибутирата накапливают бактерии иэ родов: А1саидепе8, Спготайит, Нурпот1сгоЫит, Меигу1- оЪасгегшт, 1ЫосагсНа, Рвеийотопав, КЫгоЪшт, 5рт11ит, 51гер1отусе5, УНто и др. Однако лишь три рода являются перс- пективными для промышленного биосинтеза биополимера: А1сапдепе8, Аго1оЬас1ег и Ме1пу1оЪас1епит. Они способны накап- ливать полиоксибутират на относительно недорогих субстратах (ацетат, водород, меласса, метанол, сахароза, этанол). Контроль за накоплением полимера в клетках относительно легко проводить с помощью ИК-спектрофотометрии.
При лимитировании роста продуцента по какому-либо источ- нику питания (углерод, азот, сера, фосфор) или по кислороду происходит накопление полиоксибутирата, синтезирующегося че- рез АцКоА. Процесс ферментации может быть одностадийным или двухстадийным, когда вначале накапливают биомассу клеток на сбалансированной среде по источникам питания и дыхания, а затем ее переводят в условия лимитированного роста и развития.
Для выделения полимера отсепарированные клетки экстраги- руют, например, 1,2-дихлорэтаном, или дезинтегрируют с после- дующей обработкой, исходя из целевых установок на получение целевого продукта.
Получение микробных иммунобиологических препаратов
К микробным иммунобиологическим препаратам относят вак- цины, диагностикумы, аллергены.
Вакцины - по праву занимают ведущее место в профилактике инфекционных заболеваний. Миллионы детей и взрослых ежегод- но "прививают" во всем мире вакцинами из бактерий и вирусов. Вакцины давно подразделяют на корпускулярные и растворимые. К числу первых относят, как правило, вакцины из убитых или
479
ослабленных живых клеток патогенов. К вторым — так называе- мые химические вакцины. Однако, такое деление теперь оказыва- ется недостаточным и наиболее адекватной классификацией вак- цин является следующая:
из клеток прокариот и эукариот
живые
убитые т
из клеточных компонентов
полисаха— ридные
рибосо— малыше
т
Вирусные
А, из вирионов 1. анатоксины 1. живые (токсоиды) 2. инактиви—
рованные
Б. из компо- нентов вири- онов
1. субъеди—
ничные
1
Генноинже— нерные
Подбор или создание вакцинных штаммов—дело чрезвычайно важное, кропотливое и ответственное. В настоящее время под эгидой Всемирной организации здравоохранения (ВОЗ) и под контролем соответствующих служб здравоохранения стремятся повсеместно (в том числе — в России) проводить мероприятия по профилактике эпидемических инфекционных заболеваний с по- мощью стандартных вакцинных препаратов. Основные требования к вакцинам — высокая иммуногенность и безвредность для людей и животных.
Вакцины могут быть в виде монопрепаратов, предназначенных для профилактики специфических инфекций, а также в ассоции- рованной форме для создания иммунитета против нескольких инфекций.
Вакцины из клеток патогенных микробов
Вакцины живые. Это взвеси клеток вакцинных штаммов микроорганизмов, стойко утратившие способность вызывать ин- фекционное заболевание у человека, животного, но приживающи- еся в нем. Такие штаммы, называемые аттенуированными (от лат. аИепиагив — ослабленный, тонкий, уменьшенный), могут быть природными (спонтанные мутанты) или полученными искусствен- но в лабораторных условиях (созданные мутанты).
Технология получения живых вакцин включает следующие этапы:
1) размножение вакцинного штамма в несколько пассажей от культуры на средах в пробирках и до ферментатора в оптимальных условиях. Продолжительность этапа зависит от скорости размно- жения микроорганизма (для сравнения можно назвать сальмонел- лы и микобактерий туберкулеза). Режим культивирования - как правило периодический;
"2)" сепарирование клеток от ку1штуральной жидкости, напри- мер, центрифугированием;
3) ресуспендирование клеток в подходящем растворителе (смесь сахарозы и желатина - для вакцины БЦЖ, вода - для туляремийной вакцины и т. д.);
4) розлив суспензии по ампулам или флаконам;
5) лиофильное высушивание, запаивание ампул или укупори- вание флаконов.
Живые вакцины не должны содержать консервантов или ка- ких-либо других ингибиторов роста и развития вакцинных штам- мов. Если живые вакцины выпускают в живом виде, то в качестве суспензионной среды можно использовать какие-либо стабилиза- торы или забуференный изотонический раствор натрия хлорида.
В России изготавливают следующие живые вакцины: М-44 против лихорадки Ку, бруцеллезную накожную, БЦЖ для внутри- кожного применения, сибиреязвенную (для людей) - вакцина СТИ для накожного или подкожного применения, сыпнотифозную ком- бинированную (ЖКСВ-Е), туляремийную накожную, чумную.
Живые вакцины вводят обычно однократно.
Вакцины убитые из клеток патогенов представляют собой взвеси клеток болезнетворных бактерий или грибов, обладающих выраженной иммуногенностью, но лишенные патогенности. Технология изготовления таких вакцин принципи- ально сводится к следующему: выращивание стандартного произ- водственного штамма на подходящей питательной среде; обезвре- живание (инактивирование) клеток одним из нижеуказанных ме- тодов; сепарирование клеток (чаще — с помощью центрифугиро- вания); ресуспендирование клеток в изотоническом растворе на- трия хлорида до определенной концентрации; контроль на отсут- ствие живых клеток патогена, на иммуногенность и по другим показателям, предусмотренным в научно-технической документа- ции.
Обезвреживание клеток проводят одним из следующих мето- дов: прогреванием, обработкой формалином, ацетоном, этанолом. Инактивированные разведенные взвеси микробов разливают в Ют. 8524 . 481
ампулы или флаконы и хранят при 2—10°С. Основной способ применения убитых вакцин — подкожные инъекции.
Убитыми являются вакцины против бруцеллеза (лечебная), брюшного тифа, гонореи, дизентерии Флекснера-Зонне, коклюша, лептоспироза, паратифов, холеры.
Крупномасштабного производства убитых вакцин против гриб- ковых заболеваний пока нет, но в некоторых случаях в лаборатор- ных условиях изготавливают аутовакцины для лиц с гипоэргией при микозах или для пациентов, состояние которых оценивают близким к анергии (например, при кандидозе).
Вакцину против брюшного тифа, инактивированную ацетоном, выпускают в сухом виде.
Вакцины из клеточных компонентов патогенных микробов
Вакцины полисахаридные. Полисахариды, или гликаны определяют антигенную специфичность ряда возбудите- лей инфекционных заболеваний, поэтому антигенноактивные из них выделяют в индивидуальном состоянии. Такими вакцинами являются менингококковая и пневмококковая. Вакцинные штаммы выращивают на жидких питательных средах, клетки сепарируют, промывают водой и капсульный материал экстрагируют каким-ли- бо методом, переводя полисахарид в водный раствор. Если гликан также накапливается в культуральной среде, то его можно выде- лить в чистом виде.
Из водных растворов менингококковые полисахариды осажда- ют катионным ПАВ — гексадецилтриметиламмоний бромидом, пневмококковые полисахариды — этанолом. Дополнительную очи- стку таких препаратов можно проводить с помощью этих же реагентов из водных растворов.
Менингококковые и пневмококковые полисахаридные вакци- ны, как правило, являются поливалентными. Из них первые вклю- чают обычно 4 типа гликана, вторые — 23 типа (всего типировано свыше 80 сероваров пневмококков).
В России (на предприятии НИИЭМ им. Г. Н. Габричевского) к 1982 г. освоены менингококковые полисахаридные вакцины — моновалентная типа А и бивалентная типов А+С. Культуры вак- цинных штаммов менингококков выращивают 8—10 часов в опти- мальных условиях при 37°С до плотности 6—7 • 109 клеток в 1 мл (для менингококков типа А) и 8—10 • 109 клеток в 1 мл (для менингококков типа С). Затем клетки сепарируют и подвергают обработке по следующей схеме:
Бактериальная культура
| +цетавлон Осадок комплекса "цетавлон—полисахарид" — ЦП
I экстрация 1М раствором СаС12
ЦП в экстракте
+ этанол до концентрации 25%
Осадок — отход
(нуклеиновые кислоты + ЛПС)
Надосадок
| + этанол до концентрации 80%
Осадок полисахарида—сырца
+0.3М раствор натрия ацетата (рН7,2)
Полисахарид—сырец в растворе | + фенол Депротеинизированный раствор полисахарида
| диализ против 0,1М раствора СаС12 г— Диализованный раствор полисахарида—| А—полисахарид С—полисахарид
ультрацентри— фугирование
Надосадок полисахарида С
+ этанол (4 объема) + |
Осадок полисахарида А Осадок полисахаридаС
промывание этанолом, ацетоном; высушивание над СаС12
Очищенный полисахарид А
Очищенный полисахарид С
Очищенные полисахариды с лактозой — наполнителем реко- мендованы в качестве вакцинирующих препаратов.
Полисахаридный У±-антиген из 5а1топе11а гур1п (штамм Ту2) входит в состав брюшнотифозной спиртовой вакцины. В 1 мл такого препарата содержится 5 • 108 клеток 3. гурЫ и 400 мкг У1-антигена. Вакцину вводят подкожно.
В США изготавливают полисахаридные вакцины из некоторых видов Рзеийотопаз (в частности, Р. Яиогезсепз).
Рибосомальные вакцины. У прокариот рибосомы содержат примерно 60% РНК и 40% белка, у эукариот — 55% и 45% соответственно. В стационарной фазе размножения бактериальная клетка содержит 104 рибосом; это число возрастает в период юд-фазы. Впервые рибосомальный препарат из авирулентного штамма МусоЬас1епит плЪегсшозхз приготовили Юманс А. С. и Юманс Г. П. (1965). Рибосомы в чистом виде не применяют в качестве вакцин, но обогащенные ими полисахаридные и другие антигенные препараты используют на практике. Наиболее извест- ный из них "Рибомунил 0-53", выпускаемый во Франции. Он включает рибосомы из клеток К1еЬз1е11а рпеитотае, 51гер1ососсиз рпеитотае, 5. руодепез и НаеторЬПиз тЯиепхае с добавлением протеогликана из К. рпеитотае: Применяют рибомунил интрана- зально. Его рекомендуют для профилактики заболеваний дыхатель- ной системы и для лечения ринитов, риносинусйтов и ринофарин- гитов — в особенности.
Известен препарат в виде экстракта из клеток 51гер1ососсиз пшьапз, обогащенный рибосомами. Схема его приготовления сле- дующая:
51гер1ососсиз ти1апз серотип д, нативные клетки — 100 г
1
Дезинтеграция клеток с помощью стеклянных бус — баллотини (100 г) в 100 мл 10'2 М фосфатного буфера (рН 7,4) с 10"2 М МдС12 (РМВ) и 3 мкг ДНК-азы/мл.
1 _
Неразрушенные клетки и остатки клеток отделяют низкоско- ростным центрифугированием (дважды по 10 мин. при 27000 д и 47000 д).
1
Рибосомы отмывают 5 раз в РМВ в течение 2,5 часов при 250000 д с последующим двухкратным центрифугированием в течение 20 мин. при 47000 д, а затем фильтруют через стерильный мембран- ный фильтр (0,45 мкм).
1
Препарат-экстракт З.пншшз, обогащенный рибосомами.
В Японии для предупреждения коклюша у детей используют вакцину из филаментозного гемагглютинина и лимфоцитстимули- рующего фактора из Вогг1е1е11а реггиз513.
484 * • '
Вакцины из продуктов метаболизма патогенных микроорга- низмов
Анатоксины (токсоиды) — см. раздел "Токсины и анатоксины" в данной главе. Вакцины вирусные.
По аналогии с бактериальными вакцинами вирусные также подразделяют на живые и инактивированные. Для приготовления обоих типов вирусных вакцин необходимо нако- пить вирусный материал (вирионы), используя либо куриные эмбрионы, либо культуры тканей из почек обезьян, куриного эмбриона, диплоидных клеток человека. Так вакцинный вирус гриппа (авирулентный) накапливают в аллантоисной жидкости эмбриона, которую затем отсасывают и центрифугируют. Если предполагают готовить живую вакцину, то вирус суспендируют и разводят до нужной концентрации и подвергают лиофильному высушиванию.
Для получения вакцины против желтой лихорадки также зара- жают куриный эмбрион, в нервных тканях которого накапливается патоген (аттенуированный штамм 17 И). Последующие этапы технологии получения вакцины заключаются в гомогенизации эмбриона в стерильной воде, получают "пюре", которое центрифу- гируют, осадок представляет отход, а надосадочную жидкость, содержащую вирус, лиофильно высушивают.
Культуры тканей, зараженные вирусами, выращивают в жид- ких средах, поэтому вирусный материал можно получить после фильтрации культуральной жидкости. Учитывая тот факт, что вакцинные штаммы вирусов являются, как правило, аттенуирован- ными, то стадия инактивации при их изготовлении отпадает сама собой. Однако, имеются исключения из этого правила — вакцины против бешенства и полиомиелита; первую инактивируют В-про- пиолактоном, вторую — либо Р-пропиолактоном, либо формали- ном.
Очищенный вирусный материал, готовый для приготовления вакцин, или готовые вирусные вакцины сохраняют при -70°С.
Вирусные вакцины не сочетают в себе разные виды, но, например, инактивированнаян живая полиомиелитные вакцины или убитая гриппозная вакцина почти всегда содержат разные серотипы вирусов.
"Живые ослабленные вирусные вакцины в виде суспензий теряют свою потенциальную активность достаточно быстро, поэ- тому их сохраняют либо в замороженном состоянии, или добавля- ют стабилизаторы — сахарозу, магния хлорид.
Живыми вирусными вакцинами являются: гриппозные интра- назальные для детей и взрослых (профилактические), гриппозная пероральная для детей и взрослых (лечебно-профилактическая),
против желтой лихорадки, коревая, против краснухи, полиомие- литная пероральная, против свинки.
К инактивированным вирусным вакцинам относятся: антира- бические сухая МИВП и типа Ферми, против клещевого энцефа- лита.
Субъединичные, или расщеп л.е иные вак- цины. Такие вакцины можно получать из оболочечных вирусных конъюгированных или неконъюгированных белков. Пока внедре- на в производство лишь субъединичная гриппозная вакцина, вклю- чающая гликопротеин-гемагглютинин из одного или нескольких штаммов вируса. Клиническим, испытаниям подвергаются вариан- ты субъединичньгх вакцин вируса иммунодефицита человека, уси- ленные мурамилди- и мурамилтрипептидами.
Технология получения гемагглютинина из гриппозных вирио- нов заключается в следующем: накопленный вирусный материал в аллантоисной жидкости куриного эмбриона сепарируют, подвер- гают микрофильтрации и фильтрационному концентрированию примерно в 50 раз, при необходимости дополнительно очищают ультрацентрйфугированием в градиенте плотности сахарозы; кон- центрированный вирионный материал обрабатывают катионным ПАВ и отделяют гемагглютинины ультрафильтрацией с последую- щими диализом и стерилизующей фильтрацией. На последней стадии стандартизируют и контролируют субъединичную вакцину (особенно — на отсутствие живых гриппозных вирусов).
Генно-инженерные вакцины
Биотехнология таких вакцин базируется на возможности пере- носа фрагментов хромосомной ДНК или плазмид из бактерий или вирусов в клетки других видов бактерий или дрожжей, то есть не в природные для них реципиентные клетки. Таким путем создана возможность продукции поверхностного антигена вируса гепатита В (НВвАд) дрожжевыми клетками. Этот антиген отделяют от дрожжей-продуцентов и используют для приготовления вакцины.
рДНК-биотехнология в этом направлении "становится на ноги" и за ней большое будущее на пути создания генно-инженерных вакцин, а также белковых иммуногенов и других белков, включая стафилококковый белок А и стрептококковый белок М.
На подходе к широкому внедрению вакцины против некоторых протозойных инфекционных заболеваний (например, малярии).
Диагностикумы
Диагностические приемы при инфекционных заболеваниях могут быть сведены к серодиагностике, аллергодиагностике и фагодиагностике, если иметь в виду лишь использование биопре- паратов. Серодиагностику выполняют с сыворотками крови, при- меняя соответствующие антигенные препараты, называемые диагностикумами; аллергодиагностику проводят в форме
аллергических проб с аллергенами на людях (на животных — в эксперименте или при наличии у них инфекционных заболеваний); фаги оценивают по литическому действию на чувствительные клетки соответствующих видов бактерий. Аллергены и бактерио- фаги выделены в самостоятельные подразделы (см.).
Диагностикумы могут представлять из себя убитые клетки с выраженной чувствительностью к специфическим антителам, а также отдельные, хорошо изученные антигенные компоненты. Так у энтеробактерий известны Н-, О- и\ Уьантигены, из которых первый термолабилен, второй и третий — термостабильны. На этом основано их выделение из клеток. Жгутиковый Н-антиген изолируют с помощью 0,2% раствора формалина спустя сутки после его добавления и выдержки при 37°С; О- и У1-антигены экстраги- руют при повышенных температурах водой или другими раство- рителями. Такие антигены используют как таковые или в адсор- бированном виде на эритроцитах, предварительно обработанных таннином или формалином.
Бактериальные и эритроцитарные диагностикумы применяют соответственно в реакциях агглютинации и гемагглютинации.
Для диагностики сифилиса выпускают кардиолипиновый анти- ген для реакции микропреципитации. Этот антиген включает 3 очищенных липида: 0,03% 1,3-дифосфатглицерина (кардиолипин), 0,27% фосфатидилхолина (лецитин) и 0,9% холестерина в абсолют- ном этаноле. Препарат выпускают в ампулах по 2 мл. Срок хранения — 4 год. Инактивированные вирусные диагностикумы используют в реакциях связывания комплемента, нейтрализации и торможения гемагглютинации.
Кроме вышеназванных диагностикумов производят: единый бруцеллезный диагностикум из убитых фенолом бруцелл и под- крашенный метиленовым синим; гриппозный диагностикум в виде взвеси инактивированных формалином или мертиолатом вирионов в аллантоисной жидкости куриных эмбрионов; диагностикум инак- тивированного вируса клещевого энцефалита (суспензия мозга белых мышей, зараженных этим вирусом); эритроцитарный У1-ди- агностикум, содержащий У1-антиген 5а1топе11а гурЫ, и О-диагно- стикум сальмонеллезный, включающий О-антиген из разных групп сальмонелл.
Аллергены
Аллергены по своему происхождению подразделяют на микро- бные, растительные и животные. Их используют для диагностики патологических, процессов, в развитии которых заметную роль играет сенсибилизация макроорганизма соответствующим антиге- ном-аллергеном.
Микробные аллергены изготавливают разными способами. На- тивные аллергены — это взвесь убитых бактерий и растворимых
продуктов их метаболизма; очищенные аллергены — это осажден- ные и лиофильно высушенные термостабильные фракции фильт- ратов 5—6 суточных бульонных культур бактерий, в которых содержатся свыше 80% белков, около 7% углеводов и до 10% нуклеиновых кислот.
К разряду бактериальных относятся аллергены: антраксин, бруцеллин, дизентерии, дифтероида, листерийный, малеин, ката- ральной нейссерии, лепромин, орнитозный, палочки дифтерийной нетоксигенной, кишечной палочки, ложнодифтерийнрй палочки, синегнойной палочки, пестин, стафилококковые видовые, стреп- тококковые видовые, токсоплазмин, энтерококковый, альттубер- кулин Коха, туберкулин очищенный (РРО-Л), туберкулин очищен- ный сухой (РРБ), тулярин и др.
Грибковые аллергены обычно выделяют из клеток зрелых культур, реже — из культуральных жидкостей. Они представляют собой белково-углеводные комплексы. Выпускают их в ампулах по 1 мл.
Из грибковых аллергенов известны: бластомицин, гистоплаз- мин, кандидин, кокцидиоидин, а также аллергены из некоторых плесневых грибов (аспергиллов, пенициллов) и дерматофитов.
Бактериофаги
Бактериофаги используют для фаготипирования бактерий и с лечебно-профилактическими целями.
Для индикации бактерий изготавливают так называемые видо- вые и типовые фаги: брюшно-тифозные ЛЯ-типовые, дизентерий- ные индикаторные, паратифозные В-типовые, сальмонеллезный идикаторный, стафилококковые типовые.
Фаги для профилактики и лечения инфекционных заболеваний выпускают моно- и поливалентными, их нельзя подменять диагно- стическими фагами, равно как и наоборот—диагностические фаги нельзя использовать вместо лечебно-профилактических фагов. Из числа последних отечественные предприятия выпускают жидкие моновалентные стафилофаги, стрептококковый фаг, фаг пиоциа- неус, фаги протейный и коли-протейный, коли-фаг, поливалентный дизентерийный (жидкий, сухой и в суппозиториях), поливалентные салъмонеллезные (жидкий и сухой).
Производство фагов основано на заражении бактериофагами чувствительных бульонных культур определенных видов и штам- мов. "Вегетация" фагов сопровождается при этом лизисом бакте- риальных клеток. От части нелизировавшихся клеток и клеточного детрита освобождаются стерилизующей фильтрацией. Фаги про- ходят через фильтр, фильтраты тестируют по эталонным культурам чувствительных бактерий.
В жидкие препараты лечебно-профилактических фагов можно добавлять консерванты.
