
- •Введение и краткая история биохимии. Роль и место биохимии в системе естественных наук. Значение биохимии для промышленности, сельского хозяйства и медицины.
- •Структура клетки и биохимическая характеристика отдельных субклеточных компонентов.
- •Аминокислотный состав белков. Классификация аминокислот. Протеиногенные и непротеиногенные аминокислоты.
- •Физико-химические свойства аминокислот. Кислотно-основные свойства аминокислот. Амфотерность. Изоэлектрическая точка. Буферные свойства.
- •Реакции на аминогруппу и карбоксильную группу. Реакции на отдельные аминокислоты.
- •8.Структурная организация белков. Первичная, вторичная, третичная и четвертичная структура белков.
- •Четвертичная структура
- •9. Структура пептидной связи. Элементы вторичной структуры: альфа-спирал и бета-структура. Домены в структуры белка, их функциональная роль.
- •10. Методы изучения структуры белка. Физико-химические свойства белков. Методы оценки размеров и формы белковых молекул. Денатурация и ренатурация белка.
- •13. Физико-химические свойства белков: молекулярная масса, кислотно-основные свойства белков. Заряд белковой молекулы, изоэлектрическая точка. Буферные свойства белков.
- •14. Растворимость, коллоидные свойства, денатурация и оптические свойства белков.
- •17. Скорость химических реакций и сущность явления катализа.Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18. Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •33. Переаминирование аминокислот, его механизм, биологическое значение. Процессы дезаминирования и декарбоксилирования аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине.
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •41. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •50. Над и надф-зависимые дегидрогеназы.
- •51. Флавиновые ферменты, убихинон, цитохромы и цитохромоксидаза.
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •53. Митохондрии, структура и энергетические функции. Трансмембранный потенциал ионов водорода как форма запасания энергии.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
ТРАНСАМИНИРОВАНИЕЭта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой.Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).
ГЛАВНЫЕ ОСОБЕННОСТИ РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ:1. Это циклический процесс, все стадии которого катализируются одним и тем же ферментом - трансаминазой данной пары кислот. В этот цикл вступает одна аминокислота и кетокислота (в приведенном примере - это глутамат и ПВК). Образуются другая альфа-кетокислота и аминокислота (в приведенном примере - альфа-кетоглутарат и аланин).2. Все стадии этого процесса обратимы. Поэтому весь цикл в целом может протекать как в прямом, так и в обратном направлении. Направление этого цикла зависит от соотношения концентраций участников реакции - всех четырех кислот. Резко повысив концентрацию какой-либо одной из кислот, можно направить реакцию по определенному направлению.3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. По участникам процесса для данного фермента дают ему название:Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)).4. Трансаминазы обычно обладают высокой субстратной специфичностью и высокой активностью. Наиболее активными в клетках являются те трансаминазы, для которых хотя бы один из субстратов является дикарбоновой альфа-кетокислотой - это АлТ - аланинаминотрансфераза (ГПТ) и АсТ - аспартатаминотрансфераза (ГЩТ).
Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза.
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ. 1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты.Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток). В основе этой роли - полная обратимость реакции трансаминирования.2. ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ.3. ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫОбразование аммиака.
КОСВЕННОЕ ДЕЗАМИНИРОВАНИЕ (ТРАНСДЕЗАМИНИРОВАНИЕ).Оксидазы аминокислот в клетках организма человека имеют очень низкую активность. Поэтому прямое окислительное дезаминирование аминокислот почти не протекает. Исключением является никотинамидный фермент глутаматдегидрогеназа, который легко дезаминирует глутаминовую кислоту, расщепляя ее до NH3 и альфа-кетоглутарата. Альфа-кетоглутарат может легко вступать в реакции трансаминирования с другими аминокислотами, превращаясь обратно в глутаминовую кислоту.
Таким образом, глутаминовая кислота работает в паре с альфа-кетоглутаровой: альфа-кетоглутарат принимает у разных аминокислот азот в форме аминогруппы, превращаясь в глутамат; глутамат легко дезаминируется прямым путем высокоактивной глутаматдегидрогеназой с образованием аммиака.
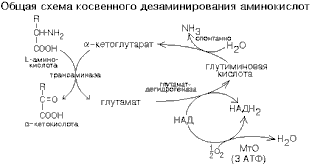 Общий
итог косвенного дезаминирования такой
же, как и результат прямого окислительного
дезаминирования.Это вариант дезаминирования,
который протекает в две стадии:а)
трансаминирование с участием
альфа-кетоглутаровой кислоты;б)
дезаминирование образовавшейся на
первой стадии глутаминовой кислоты.Косвенное
дезаминирование является наиболее
важным, т.к. именно таким путем
дезаминируются большинство аминокислот
живого организма. Это обусловлено тем,
что фермент глутамат-ДГ более активен,
чем оксидазы аминокислот.
Общий
итог косвенного дезаминирования такой
же, как и результат прямого окислительного
дезаминирования.Это вариант дезаминирования,
который протекает в две стадии:а)
трансаминирование с участием
альфа-кетоглутаровой кислоты;б)
дезаминирование образовавшейся на
первой стадии глутаминовой кислоты.Косвенное
дезаминирование является наиболее
важным, т.к. именно таким путем
дезаминируются большинство аминокислот
живого организма. Это обусловлено тем,
что фермент глутамат-ДГ более активен,
чем оксидазы аминокислот.
Амиды
карбоновых кислот – это органические
производные аммиака, в которых один,
два или три водородных атома аммиака
замещены на ацильную группу RC(O)–, где
R – водород, арильная, алкильная или
амидная группа как, например, в формамиде
HCONH2,
ацетамиде CH3CONH2
и мочевине NH2CONH2.
(В отличие от амидов при замещении атомов
водорода в молекуле аммиака на
углеводородные радикалы образуются
амины. Отсюда другое название группы
–NH2:
аминогруппа.) Органические амиды могут
рассматриваться и как производные
органических кислот, в которых
гидроксильная группа (–OH) кислоты
замещена амидной группой. Например:
![]() Такие
реакции действительно происходят.
Подобно аминам, органические амиды
подразделяются на первичные, вторичные
и третичные в зависимости от числа
водородных атомов аммиака, подвергшихся
замещению, при этом по крайней мере одна
из замещающих групп ацильная. Большинство
амидов – химически устойчивые твердые
вещества с относительно низкими
температурами плавления. Их используют
для приготовления растворителей, лаков,
взрывчатых веществ, удобрений, лекарств
и пластмасс. Некоторые сульфамиды,
производные сульфокислот, используются
в качестве лекарственных средств
(сульфаниламидные препараты). Найлон –
это полиамид, в молекуле которого амидные
группы –CONH– связывают между собой
мономерные единицы в полимерную цепь.
Белки также представляют собой полиамиды,
но у них связывающие амидные группы
расположены ближе друг к другу, чем в
найлоне; кроме того, белки имеют
разнообразные боковые цепи.
Такие
реакции действительно происходят.
Подобно аминам, органические амиды
подразделяются на первичные, вторичные
и третичные в зависимости от числа
водородных атомов аммиака, подвергшихся
замещению, при этом по крайней мере одна
из замещающих групп ацильная. Большинство
амидов – химически устойчивые твердые
вещества с относительно низкими
температурами плавления. Их используют
для приготовления растворителей, лаков,
взрывчатых веществ, удобрений, лекарств
и пластмасс. Некоторые сульфамиды,
производные сульфокислот, используются
в качестве лекарственных средств
(сульфаниламидные препараты). Найлон –
это полиамид, в молекуле которого амидные
группы –CONH– связывают между собой
мономерные единицы в полимерную цепь.
Белки также представляют собой полиамиды,
но у них связывающие амидные группы
расположены ближе друг к другу, чем в
найлоне; кроме того, белки имеют
разнообразные боковые цепи.
