
- •Введение и краткая история биохимии. Роль и место биохимии в системе естественных наук. Значение биохимии для промышленности, сельского хозяйства и медицины.
- •Структура клетки и биохимическая характеристика отдельных субклеточных компонентов.
- •Аминокислотный состав белков. Классификация аминокислот. Протеиногенные и непротеиногенные аминокислоты.
- •Физико-химические свойства аминокислот. Кислотно-основные свойства аминокислот. Амфотерность. Изоэлектрическая точка. Буферные свойства.
- •Реакции на аминогруппу и карбоксильную группу. Реакции на отдельные аминокислоты.
- •8.Структурная организация белков. Первичная, вторичная, третичная и четвертичная структура белков.
- •Четвертичная структура
- •9. Структура пептидной связи. Элементы вторичной структуры: альфа-спирал и бета-структура. Домены в структуры белка, их функциональная роль.
- •10. Методы изучения структуры белка. Физико-химические свойства белков. Методы оценки размеров и формы белковых молекул. Денатурация и ренатурация белка.
- •13. Физико-химические свойства белков: молекулярная масса, кислотно-основные свойства белков. Заряд белковой молекулы, изоэлектрическая точка. Буферные свойства белков.
- •14. Растворимость, коллоидные свойства, денатурация и оптические свойства белков.
- •17. Скорость химических реакций и сущность явления катализа.Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18. Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •33. Переаминирование аминокислот, его механизм, биологическое значение. Процессы дезаминирования и декарбоксилирования аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине.
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •41. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •50. Над и надф-зависимые дегидрогеназы.
- •51. Флавиновые ферменты, убихинон, цитохромы и цитохромоксидаза.
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •53. Митохондрии, структура и энергетические функции. Трансмембранный потенциал ионов водорода как форма запасания энергии.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
33. Переаминирование аминокислот, его механизм, биологическое значение. Процессы дезаминирования и декарбоксилирования аминокислот.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТУ человека происходит в основном путем окислительного дезаминирования. Эти реакции протекают с помощью двух ферментов:- оксидаза Д-аминокислот- оксидаза L-аминокислот
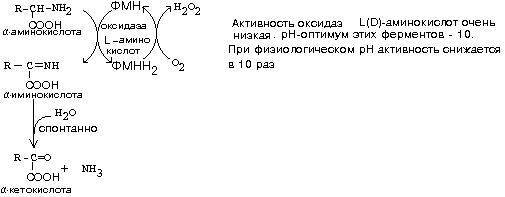
Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом - он ингибируется избытком АТФ, и активируется избытком АДФ.
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот. 2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма.3. Другой продукт реакции дезаминирования - альфа-кетокислота.
Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Большинство альфа-кетокислот тем или иным путем превращаются в кислоты, которые являются промежуточными метаболитами ЦТК:- в альфа-кетоглутаровую; - в янтарную;- фумаровую; - щавелево-уксусную. Все эти метаболиты могут в организме трансформироваться в углеводы, перед этим превращаясь в ПВК. Поэтому большинство аминокислот относится к группе, которая называется ГЛЮКОГЕННЫМИ АМИНОКИСЛОТАМИ (их 17). Только 3 аминокислоты не могут превращаться в ПВК, но превращаются в Ац-КоА - КЕТОГЕННЫЕ АМИНОКИСЛОТЫ: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
Метаболические пути, в которые вступают аминокслоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров.
Д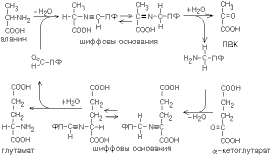 ЕКАРБОКСИЛИРОВАНИЕВ
природе встречаются разные типы
декарбоксилирования аминокислот. В
организме человека происходит только
окислительное
декарбоксилирование.
Ферменты - декарбоксилазы. Их простетическая
группа представлена пиридоксальфосфатом
- это активная форма витамина В6:
ЕКАРБОКСИЛИРОВАНИЕВ
природе встречаются разные типы
декарбоксилирования аминокислот. В
организме человека происходит только
окислительное
декарбоксилирование.
Ферменты - декарбоксилазы. Их простетическая
группа представлена пиридоксальфосфатом
- это активная форма витамина В6:
![]()
![]() В
реакциях декарбоксилирования участвует
альдегидная группа пиридоксальфосфата:
В
реакциях декарбоксилирования участвует
альдегидная группа пиридоксальфосфата:
Аминокислота соединяется с активным центром фермента, в состав которого входит альдегидная группа ПФ. Образуются Шиффовы основания (альдимины и кетимины). В результате СООН-группа становится лабильной и отщепляется в виде СО2. Далее происходит гидролиз до соответствующего амина. Эта реакция необратима. Отнятие СО2 происходит без окисления. Субстратная специфичность декарбоксилаз очень разная.
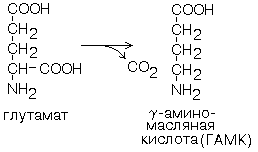
2. ОРНИТИН-ДЕКАРБОКСИЛАЗА - высокоспецифичный фермент. Катализирует превращение орнитина в путресцин:
![]()
![]()
Орнитиндекарбоксилаза - это первый фермент на пути образования путресцина и остальных полиаминов, это регуляторный фермент процесса.
ПЕРЕАМИНИРОВАНИЕ (трансаминирование), обратимый перенос аминогруппы из молекулы одного орг. соед. в молекулу другого. Наиб. роль переаминирование играет в биохимии в процессах метаболизма азотистых оснований в тканях животных и растений.Переаминирование аминокислот может происходить и вне клетки в присут. пиридоксаль-5'-фосфата, однако скорость р-ции в 106 раз меньше. Специфичность действия определяется пространств, структурой субстрата, положением ионогенных групп белка, осуществляющих кислотно-основной катализ, и геометрией связывания субстрата.Нарушение нормального течения переаминирования в организме наблюдается при патологич. состояниях, напр. при инфаркте миокарда, заболеваниях печени. Контроль концентрации аминотрансфераз используется в этих случаях как ср-во диагностики. Переаминирование в организме подавляется противотуберкулезными лек. ср-вами (изониазидом, циклосерином и др.), а также при В6-авитаминозе.
ДЕЗАМИНИРОВАНИЕ (деаминирование), удаление группы NH2 из молекул орг. соединений. Сопровождается замещением аминогруппы на др. группу или образованием кратной связи. Осуществляется под действием HNO2, нитрозилсерной к-ты, N2O3, N2O4, H2O, H2, а также ферментов. Наиб. универсальный метод дезаминирования аминов - взаимод. их с HNO2. Сущность метода состоит в обработке кислых водных р-ров аминов нитритом К или Na, в результате чего образуются соли диазония (см. Диазотирование, Диазосоединения). В случае алифатич. аминов эти соли неустойчивы и разлагаются с выделением N2 и образованием карбкатиона, к-рый взаимод. с нуклеоф. агентами среды (вода, анионы и др.) или стабилизируется с образованием олефина.
ДЕКАРБОКСИЛИРОВАНИЕ, элиминирование СО2 из карбоксильной группы карбоновых к-т или карбоксилатной группы их солей. Осуществляют обычно нагреванием в присут. к-т или оснований. Декарбоксилирование монокарбоновых насыщенных к-т протекает, как правило, в жестких условиях. Так, прокаливание ацетата Na с избытком натронной извести приводит к отщеплению СО2 и образованию метана: CH3COONa + NaOH 001= CH4 + Na2CO3.
