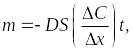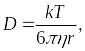Коллоквиум III термодинамика разбавленных растворов теоретическая часть
3.1. свойства растворов
3.2. Роль осмоса и осмотического давления в биологических системах
3.1. Свойства растворов
Растворы – это многокомпонентные системы, в которых частицы одного вещества в виде молекул, атомов или ионов равномерно распределены в другом веществе. С термодинамической точки зрения все компоненты раствора равноценны, но обычно тот компонент раствора, который находится в избытке и том же агрегатном состоянии, что и сам раствор, называют растворителем (его будем обозначать индексом “А”). Компонент, взятый в недостатке, называют растворенным веществом (его будем обозначать индексом “В”). По относительному количеству растворенного вещества и растворителя растворы делят на:
1) разбавленные и концентрированные;
2) ненасыщенные, насыщенные и пересыщенные.
Кроме того можно выделить растворы идеальные и реальные.
Для
идеальных
растворов
с термодинамической точки зрения при
постоянных температуре и давлении их
образование характеризуется постоянством
объема (![]() ),
отсутствием выделения или поглощения
теплоты (
),
отсутствием выделения или поглощения
теплоты (![]() ),
увеличением энтропии (
),
увеличением энтропии (![]() )
уменьшением функции Гиббса (
)
уменьшением функции Гиббса (![]() ,
т. е. процесс образования раствора
самопроизвольный) и равенством энергий
взаимодействия между однородными и
разнородными частицами
,
т. е. процесс образования раствора
самопроизвольный) и равенством энергий
взаимодействия между однородными и
разнородными частицами
![]() .
.
Идеальными являются растворы, состоящие из веществ, близких по физическим и химическим свойствам. Большинство же растворов являются реальными, однако они приближаются по свойствам к идеальным при их сильном разбавлении. В этом случае частицы растворенного вещества отделены друг от друга частицами растворителя и свойства растворов не зависят от природы растворенного вещества, а только от их количества, т. е. числа частиц в единице объема (концентрации раствора). Поэтому свойства раствора, зависящие от концентрации, называют коллигативными свойствами. К ним относятся диффузия, осмос (и осмотическое давление), понижение давления насыщенного пара над раствором, повышение температуры кипения и понижение температуры замерзания.
Рассмотрим некоторые коллигативные свойства для растворов неэлектролитов, т. е. когда растворенное вещество в растворе не диссоциирует на ионы.
Диффузия
это самопроизвольный процесс переноса
вещества из мест с большей в места с
меньшей концентрацией до установления
равновесного распределения.
Согласно закона Фика масса
продиффундировавшего вещества (m)
определяется градиентом концентрации
![]() :
:
|
|
(3.1) |
где D коэффициент диффузии, численно равный количеству вещества, диффундирующего за единицу времени через 1 м2 поверхности раздела (S) при градиенте концентраций, равном 1. Коэффициент диффузии (согласно уравнению Эйнштейна Смолуховского) зависит от температуры (Т), вязкости среды () и радиуса диффундирующих частиц (r):
|
|
(3.2) |
где k постоянная Больцмана, равная 1,38 1023 Дж/K.
Объединив
формулы (3.1) и (3.2) можно заключить, что
масса продиффундировавшего вещества
в единицу времени (т. е. величина
![]() )
возрастает при повышении температуры
и градиента концентрации и уменьшается
при увеличении вязкости растворителя
и размера диффундирующих частиц.
)
возрастает при повышении температуры
и градиента концентрации и уменьшается
при увеличении вязкости растворителя
и размера диффундирующих частиц.
Процессы диффузии имеют большое значение при протекании биохимических реакций в живых организмах. Данные реакции являются многостадийными, причем самой медленной оказывается стадия «доставки сырья», т. е. диффузия реагирующих веществ в реакционную зону. Далее биохимическая реакция с участием ферментов протекает очень быстро.
Весьма важным в биологическом отношении свойством растворов является осмос, который представляет одностороннюю самопроизвольную диффузию молекул растворителя через полупроницаемую мембрану из раствора с меньшей в раствор с большей концентрацией.
Схема простейшего осмометра представлена на рис. 3.1.
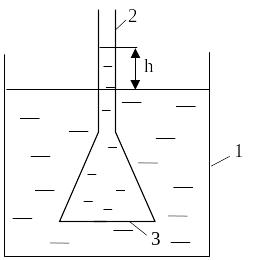
Рис. 3.1. Схема осмометра.