
Лабораторная работа 91 / 2008-05-05-16-52-Botman-9
.docОБРАБОТКА РЕЗУЛЬТАТОВ.
-
Рассчитаем показатель политропы n, доверительную погрешность
 (используя
метод косвенных измерений).
(используя
метод косвенных измерений).
Формула для расчета:
![]()
n1=![]() 1,289
1,289
n2=![]() 1,348
1,348
n3=![]() 1,400
1,400
n4=![]() 1,326
1,326
n5=![]() 1,370
1,370
n6=![]() 1,333
1,333
n7=![]() 1,356
1,356
n8=![]() 1,311
1,311
n9=![]() 1,289
1,289
n10=![]() 1,333
1,333
Рассчитываем среднее значение n
по формуле
![]()
![]() =
=![]() 1,3355
1,3355
Вычислим СКО среднего по формуле
![]()
![]() =0,0349
=0,0349
4) Проверка на промахи

P =95% N = 10 VPN =2.18
![]() =>
Следовательно, промахов нет!
=>
Следовательно, промахов нет!
5) СКО результата измерения:
![]()
Рассчитаем погрешность
![]() с
с
![]() =2.3
для N=10 и P=95%
=2.3
для N=10 и P=95%
![]() =0,0253
=0,0253
Вычислим приборную погрешность.
![]()
![]()
![]()
![]()
Приборная погрешность вычисляется по
формуле:
![]()
![]() 1=
1=![]() 0,0351
0,0351
![]() 2=
2=![]() 0,0369
0,0369
![]() 3=
3=![]() 0,0400
0,0400
![]() 4=
4=![]() 0,0359
0,0359
![]() 5=
5=![]() 0,0378
0,0378
![]() 6=
6=![]() 0,0370
0,0370
![]() 7=
7=![]() 0,0380
0,0380
![]() 8=
8=![]() 0,0360
0,0360
![]() 9=
9=![]() 0,0351
0,0351
![]() 10=
10=![]() 0,0370
0,0370
Вычислим среднюю приборную погрешность:
![]()
![]() =
=![]() 0,0369
0,0369
Полная погрешность вычисляется по
формуле
![]()
![]() =0,0253+0,0369=0,0622
=0,0253+0,0369=0,0622
Результат статистической обработки
![]() =1,34
=1,34![]() 0,06
при P=95%
0,06
при P=95%
-
Определим параметры состояния в точках 1, 2 и 3, используя уравнения термодинамических процессов. Для расчетов используем экспериментально полученные значения изменения давления и величину p2. Построим nVT цикл в координатах (p,V).
Пользуясь уравнениями адиабатного и политропного процессов, а также уравнением состояния идеального газа, рассчитаем необходимые для построения графика значения. Для этого рассмотрим участки графика термодинамического процесса, представленного на рис. 2.2.
![]()
![]()
Рассмотрим участок 1-2 графика, изображенного
на рис. 2.2. На данном участке протекает
политропный процесс, описываемый по
закону
![]() .
.
![]()

![]()
![]()
Рассмотрим участок 2-3 графика. На данном
участке протекает изохорный процесс,
описываемый по закону
![]() .
.
![]()
![]()
![]()
![]()
Для удобства сводим все полученные значения вместе:
![]()
![]()
![]()
![]()
Графики прилагаются к работе на отдельном листе
-
По формулам (2) и (3) рассчитываем мольную теплоёмкость воздуха в политропном процессе и мольную изохорную теплоёмкость воздуха.
Мольная изохорная теплоёмкость воздуха при нормальных условиях определяется числом степеней свободы (i) молекул. В нашем случае это число равно пяти:
![]()
![]() (Дж/К*моль)
(Дж/К*моль)
Мольная теплоемкость воздуха в политропном процессе:
![]()
![]() (Дж/К*моль)
(Дж/К*моль)
На рассматриваемом участке 1-2 (см. рис. 2.2) воздух охлаждается, поэтому получившееся значение с имеет знак «минус».
-
Используя уравнения состояния идеального газа, найдем число молей воздуха в сосуде
 по известным значениям p2,V1,T1.
по известным значениям p2,V1,T1.
![]()
![]()
![]() =
=
![]() 0,925
(моль)
0,925
(моль)
-
Рассчитаем изменение внутренней энергии и работу газа для всех процессов nVT-цикла.
Поскольку при изотермическом процессе
![]() =0,
то изменения внутренней энергии газа
в политропном процессе
=0,
то изменения внутренней энергии газа
в политропном процессе
![]() и при изохорном процессе
и при изохорном процессе
![]() одинаковы по значению и противоположны
по знаку.
одинаковы по значению и противоположны
по знаку.
![]()
![]() =
=![]() 5,968
(Дж)
5,968
(Дж)
Работа расширения (сжатия) в политропическом A12 и в изотермическом А13 процессах может быть рассчитана по формулам:
![]()
![]()
![]() =39,553(Дж)
=39,553(Дж)
![]()
![]()
![]() =40,408
(Дж)
=40,408
(Дж)
Все результаты представим в виде таблицы:
-
Величина
Результат вычисления
n
1,34
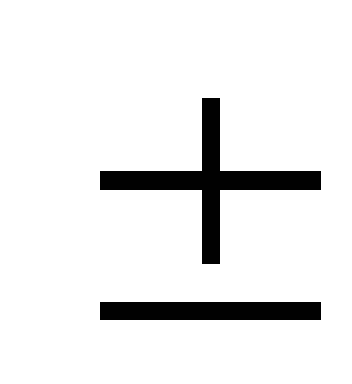 0,06
0,06p2, Па
104320
p3, Па
102508
V2=V3, м3
22,8*10-3
T1=T3, К
295,24
с, Дж/К*моль
-3,666
 ,
моль
,
моль0,925
 =
= ,
Дж
,
Дж5,968
 ,
Дж
,
Дж39,553
 ,
Дж
,
Дж40,408
Вывод:
Проведя данную лабораторную работу, мы изучили термодинамический цикл при сжатии и расширении воздуха и рассчитали для него показатель политропы, мольную теплоемкость воздуха в политропном процессе; изменение внутренней энергии и работу газа для всех процессов.
КОНТРОЛЬНЫЕ ВОПРОСЫ.
-
Параметрами состояния называются объем V, температура T и давление p газа.
-
Теплоемкость газа при постоянном давлении больше, потому что при p=const газ расширяется и часть проводимой теплоты расходуется на совершение работы над внешними телами.
-
Т.к. для трехатомного газа число степеней свободы i составляет не 5, как у двухатомного, а 7, следовательно,
 будет больше в 1.4 раза.
будет больше в 1.4 раза.
5. Работа, совершаемая идеальным газом, всегда равна нулю при изохорном процессе.
