
- •Курсова робота
- •Завдання на курсову роботу
- •4 Статистична обробка експериментальних даних 92
- •Реферат
- •1 Теоретичні основи оптичних методів аналізу
- •1.1 Ретроспективний аналіз розвитку оптичних методів аналізу
- •1.2 Фотометричний метод
- •1.2.1 Основні види фотометричного методу аналізу
- •1.3 Нефелометричний та турбідиметричний методи
- •1.4 Рефрактометричнй метод
- •1.5 Поляриметричний метод
- •1.6 Люмінесцентний метод
- •Висновки до розділу 1:
- •2 Стандартні методики проведення оптичних методів аналізу у хтнр
- •2.1 Визначення показника заломлення
- •2.1.1 Визначення вмісту цукру в харчових продуктах (соках, напоях)
- •2.2 Колориметрія та фотометрія в аналізі неорганічних речовин
- •2.2.1 Методика фотометричного визначення мангану
- •2.2.2 Методика фотометричного визначення міді
- •2.2.3 Методика фотометричного визначення нікелю
- •2.2.4 Методика фотометричного визначення кобальту
- •2.2.5 Методика фотометричного визначення хрому
- •2.2.6 Методика фотометричного визначення фосфору
- •2.3 Візуальний аналіз
- •2.4 Фотометричне визначення дихромат- і перманганат-іонів при їх сумісній присутності в розчині
- •2.5 Визначення концентрації фосфат-іонів
- •Висновок до розділу 2:
- •3 Експериментальна частина
- •3.1 Методика фотометричного визначення заліза
- •3.2 Матеріали та обладнання
- •3.3 Порядок виконання аналізу
- •3.4 Проведення аналізу
- •Висновки до розділу 3:
- •4 Статистична обробка експериментальних даних
- •4.1 Визначення статистичних критерій
- •Висновки до розділу 4:
- •Висновки
- •Список використаної літератури
2.4 Фотометричне визначення дихромат- і перманганат-іонів при їх сумісній присутності в розчині
Метою роботи є ознайомлення з фотометричним визначенням елементів при їх сумісній присутності методом калібрувального графіка.
Суть роботи заключається одночасне визначення концентрації двох речовин (хрому і марганцю) при їх сумісній присутності засноване на відмінності спектрів поглинання забарвлених розчинів перманганат- і дихромат-ионов. Спектри поглинання визначуваних іонів частково накладаються один на одного (рисунок 11).
В цьому випадку при фотометрировании з різними світлофільтрами можна нехтувати светопоглощением лише одного з компонентів забарвленої суміші.
При 550 ± 20 нм поглинає переважно перманганат-іон і оптична густина А550 обумовлена тільки перманганат-ионом (незначним светопоглощением дихромат-иона нехтуємо). При 430 ± 20 нм поглинають обидва аніони і оптичну щільність розчину Ат аддитивно складається з оптичної щільності, обумовленою перманганат-ионом, і оптичній густині, обумовленою дихромат-ионом.
Вимірюють оптичну густину стандартних розчинів КМnО4 при 550 і 430 нм і оптичну густину стандартних розчинів К2Сr2О7 при 430 нм. Будуються три калібрувальні графіки (рисунок 2.2).
По величині оптичної густини аналізованого розчину, виміряного в області 550 нм, і калібрувальної кривої 2 відразу визначають невідому концентрацію марганцю. Одночасно за допомогою калібрувальної кривої 3 визначають оптичну щільність розчину перманганат-иона при 430 нм. Потім по різниці оптичної густини досліджуваного розчину і розчину КМnО4, виміряних при 430 нм визначають концентрацію хрому.
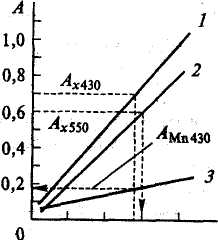
1 – крива для визначення хрому при 430 ним;
2 – крива для визначення марганцю при 550 нм;
3 – крива для визначення оптичної густини розчину перманганату калія при 430 нм
Рисунок 2.2 – Калібрувальний графік для визначення марганцю і хрому при їх сумісній присутності
Матеріали та облоднання: 50 %-ная сірчана кислота;
0,1 н. стандартний розчин КМnО4.
Перед застосуванням 9,1 см3 стандартного розчину КМnО4 поміщають в мірну колбу місткістю 100 мл і доводять розчин водою, що дистилює, до мітки. Розчин містить 0,1 міліграм марганцю в 1 см3.
Стандартний розчин K2Cr2O7: наважку 0,2818 г K2Cr2O7 поміщають в мірну колбу місткістю 1 дм3 і доводять розчин водою, що дистилює, до мітки. Розчин містить 0,1 міліграм хрому в 1 см3; досліджуваний розчин, КМnО4, що містить, і K2Cr2O7 (по вказівці викладача).
Для побудови калібрувального графіка в мірні колби місткістю 50 см3 поміщають за допомогою мікробюретки 1,0; 2,5; 5,0; 7,5 і 10 мл підготовленого стандартного розчину перманганату калія. Потім додають в кожну колбу по 5 см3 розчину сірчаної кислоти. Вміст колб доводять до мітки дистильованою водою і ретельно перемішують. Вимірюють оптичну густину отриманої серії в кюветі товщиною 1 см при довжинах хвиль 550 і 430 нм. Отримані дані поміщають в таблицю 4. За отриманими даними будують калібрувальний графік (рисунок 2.2, криві 2,3): знайдені величини оптичної густини відкладають по осі ординат, а відповідні ним концентрації (мг/50 мл) по осі абсцис.
Потім в колби тієї ж місткості поміщають такі ж кількості стандартного розчину дихромату калія. Додають в кожну колбу по 5 см3 розчину сірчаної кислоти, доводять об'єм до мітки дистильованою водою, і ретельно перемішують. Вимірюють оптичну густину в тих же кюветах при довжині хвилі 430 нм. За отриманими даними будують калібрувальний графік для дихромату калія (рисунок 2.2, крива 1).
Аліквотну порцію аналізованого розчину (5 см3) поміщають в мірну колбу місткістю 50 см3, додають 5 см3 сірчаної кислоти. Вміст колби доводять до мітки дистильованою водою і ретельно перемішують. Оптичну густину отриманого розчину вимірюють при 430 і 550 нм в кюветі товщиною 1 див. Як нульовий розчин використовують дистильовану воду.
Вміст марганцю в розчині визначають по кривій 2 (рисунок 2.2). По знайденій концентрації марганцю за допомогою кривій 3 (рисунок 2.2) визначають його оптичну густину при довжині хвилі 430 нм А430(Мn). Потім знаходять різницю оптичної густини суміші і перманганат-іонів при 430 нм за формулою
A430 (Cr) = А430(X) - А430 (Мn),
де Acr(430) оптична густина суміші, знайдена при довжині хвилі 430 нм. По знайденій величині за допомогою кривій 1 обчислюють вміст хрому в досліджуваному розчині.
