
Задача№ 2. Расчет энтропии растворения в сварочной ванне.
Определение энтропии реакции растворения 0,5% каждого из указанных вторых элементов при стандартной температуре 2000К. Примите активность растворимых за 1.
Стандартную энтропию 1 моль меди определяем по таблице:

Пересчитаем
массовую концентрацию меди
 в молярную
в молярную
 по формуле:
по формуле:
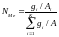
Где
 ,
, - соответственно атомная масса и массовая
концентрация i-ого
элемента;
- соответственно атомная масса и массовая
концентрация i-ого
элемента;
К-число элементов в системе.
Подставим числовые значения и получим:

Определяем энтропию 1 моль меди при температуре 2000К по формуле:
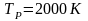 -
температура, при которой рассчитывается
энтропия (задана по условию),
-
температура, при которой рассчитывается
энтропия (задана по условию),
 -
стандартная температура, CP
– теплоемкость меди,
-
стандартная температура, CP
– теплоемкость меди,
 .
.
Получаем:

Определяем энтропию растворения меди в железе при T=2000K:

Вывод:
энтропия реакции растворения 0,5% меди
в железе при температуре 2000К равна
 .
Что почти в 4 раза больше стандартной
энтропии меди.
.
Что почти в 4 раза больше стандартной
энтропии меди.
Задача№ 3. Расчет процессов раскисления железа.
Сравнить энергию Гиббса химических реакций раскисления железа двумя элементами при температре ванны (2000K) и температуре капли (3500К).
Найдем энергию Гиббса по формуле:

Сосчитаем для каждого реакции энергию Гиббса:
Реакция 1:
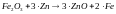





Реакция 2:


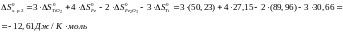


 Построим
энергию Гиббса в зависимости от
температуры:
Построим
энергию Гиббса в зависимости от
температуры:

Задача №4. Расчет процессов легирования и модифицирования.
Определить химический потенциал окисления меди (Cu), находящегося в количестве 0,5% в растворенном виде в железе в стадии капли (3500К) и в стадии ванны (2000К).
Решение:
1) Реакции раскисления, которые проходят в смеси железа и меди, имеют вид:


2) Рассчитаем молярные концентрации железа и меди в растворе ванны:

 ,
,
 ,
,
 ,
,
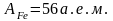
Подставим числовые значения и получим:
 .
.
Соответственно, молярные концентрации железа и меди равны:


4) Определяем изменение энтальпии химической реакции

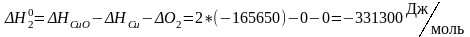
5) Определение изменения энтропии химической реакции:


6) Определение изменения молярной теплоемкости:


Таким образом, получаем выражения для нахождения зависимости энергии Гиббса от температуры:
Для уравнения 1:

Температура, К |
M0 |
|
2000 |
1,0528 |
-278 |
2100 |
1,0945 |
-267 |
2200 |
1,1346 |
-257 |
2300 |
1,1731 |
-246 |
2400 |
1,2103 |
-235 |
2500 |
1,2462 |
-224 |
2600 |
1,2808 |
-214 |
2700 |
1,3143 |
-203 |
2800 |
1,3467 |
-192 |
2900 |
1,3781 |
-182 |
3000 |
1,4086 |
-172 |
3100 |
1,4382 |
-161 |
3200 |
1,4669 |
-151 |
3300 |
1,4949 |
-141 |
3400 |
1,5221 |
-130 |
3500 |
1,5486 |
-120 |
Для уравнения 2:

T |
M0 |
|
2000 |
1,0528 |
-149 |
2100 |
1,0945 |
-130 |
2200 |
1,1346 |
-111 |
2300 |
1,1731 |
-93 |
2400 |
1,2103 |
-74 |
2500 |
1,2462 |
-55 |
2600 |
1,2808 |
-37 |
2700 |
1,3143 |
-18 |
2800 |
1,3467 |
1 |
2900 |
1,3781 |
20 |
3000 |
1,4086 |
38 |
3100 |
1,4382 |
57 |
3200 |
1,4669 |
76 |
3300 |
1,4949 |
95 |
3400 |
1,5221 |
113 |
3500 |
1,5486 |
132 |
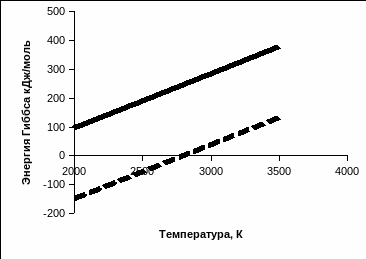
Представим

То есть


Тогда получим формулу для вычисления химического потенциала:

Для реакции окисления железа:

Для реакции окисления меди:



