
- •7.1 Электрохимические методы анализа
- •7.1.1 Краткая характеристика отдельных методов
- •2. Вольтамперометрия или полярография
- •3. Кулонометрия.
- •4. Электрогравиметрия
- •7.1.2 Виды проводимости веществ.
- •7.1.3 Зависимость проводимости от концентрации
- •7.1.4 Классификация проводников по типу проводимости.
- •7.2 Потенциометрический анализ (ионометрия)
- •7.3 Классификация и устройство электродов, применяемых в потенциометрии
- •7.3.1 Металлические электроды.
- •7.3.2 Мембранные электроды
- •7.4. Устройство и принцип работы водородного, стеклянного и хлоридсеребрянного электродов
- •7.4.1. Водородный электрод
- •7.4.2 Стеклянный (индикаторный) электрод.
- •7.4.3 Хлоридсеребряный электрод.
- •7.5 Потенциометрическое титрование
- •7.6 Метод кондуктометрии.
- •7.7 Виды электродных ячеек и их назначение
- •7.8 Применение прямой кондуктометрии.
- •7.9 Кондуктометрические кривые титрования
7.3 Классификация и устройство электродов, применяемых в потенциометрии
Для измерения электродвижущей силы ЭДС необходима ячейка, состоящая из двух электродов: индикаторного и электрода сравнения, в качестве которых используют мембранные (ионоселективные) и металлические электроды. Иногда один и тот же электрод в зависимости от среды может выполнять функции как индикаторного, так и электрода сравнения, например каломельный, хлоридсеребряный.
В соответствии с механизмом возникновения или изменения потенциала электроды классифицируются на электроды II рода (обратимые по катиону), и электроды I рода (обратимые по аниону); а также на мембранные или ион-селективные и редокс-электроды или электроды III рода.
К электродам I рода принадлежат: металлические активные (погруженные в раствор соли того же металла); газовые (стандартный водородный электрод), амальгамные электроды.
Электроды
II
рода это – металлические
индифферентные
(покрытые малорастворимой
солью того же металла), газовые (например,
хлорный:
![]() ).
Газовые электроды II
рода в количественном анализе применяют
редко.
).
Газовые электроды II
рода в количественном анализе применяют
редко.
Электроды
III
рода это индикаторные
редокс-электроды, которые имеют две
разновидности: электроды, потенциал
которых не зависит от активности ионов
водорода в растворе, например
![]() и
рН-чувствительные (хингидронный
и
рН-чувствительные (хингидронный
![]() ).
).
По назначению различают индикаторные электроды и электроды сравнения. Электроды сравнения должны обладать устойчивым во времени воспроизводимым потенциалом, не меняющимся при прохождении небольшого тока. При анализе собственный потенциал такого электрода остается постоянным. Чаще всего в качестве электродов сравнения применяют различные электроды второго рода: хлоридсеребряный и каломельный.
Основным требованием к индикаторным (измерительным) электродам является высокая селективность по определяемому иону. В процессе анализа потенциал индикаторного электрода закономерно изменяется в зависимости от концентрации потенциалопределяющего иона. Согласно терминологии ИЮПАК «ионоселективные электроды – это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от величины lga определяемого иона в растворе», где «a» – активность ионов. К устройствам с подобными свойствами принадлежат электроды с кристаллическими мембранами (первичные ионоселективные); с жесткой матрицей (стеклянные); с подвижными носителями – положительно заряженными, отрицательно заряженными и незаряженными («нейтральными») переносчиками; ферментные; сенсибилизированные (активированные) или газочувствительные. На рисунке рисунок 7.13 схематически показана описанная классификация.
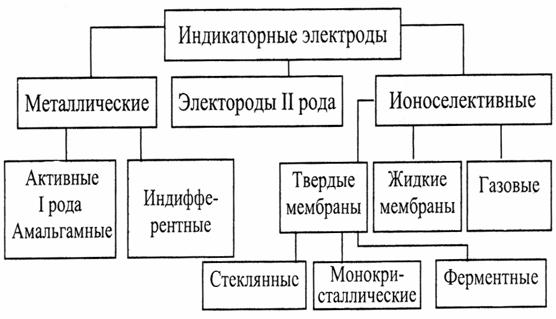
Рисунок 7.13 Классификации индикаторных электродов по конструкции.
7.3.1 Металлические электроды.
Металлические электроды I рода или активные. Их изготавливают из металлов (Ag, Pb, Cu, Cd), образующих восстановленную форму в обратимой окислительно-восстановительной системе. Они представляют собой металлическую пластинку или проволоку, погруженную в раствор хорошо растворимой соли этого же металла и дают хорошо воспроизводимые результаты. Однако электроды из хрома, кобальта и ряда других металлов с аналогичными свойствами в качестве индикаторных не используются, так как имеют низкую воспроизводимость. Воспроизводимость электродов можно значительно улучшить, если использовать не просто металл, а его амальгаму – амальгамные электроды.
Потенциал металлических электродов I рода является функцией активности собственных ионов в растворе. Для серебряного электрода обратимость описывается следующей реакцией ОВР:
![]() ,
(7.6)
,
(7.6)
а его потенциал вычисляется по уравнению Нернста как:
![]() (7.7)
(7.7)
где
![]() -
активность ионов серебра в растворе
электролита.
-
активность ионов серебра в растворе
электролита.
Электроды второго рода состоят
из металла, покрытого слоем малорастворимого
соединения этого же металла и погруженного
в раствор хорошо растворимого
соединения с тем же анионом,
т.е.
они обратимы относительно аниона.
Потенциал их зависит
только от активности анионов
труднорастворимого соединения,
входящего в состав электрода. Такими
свойствами обладают хлоридсеребряный
(![]() ),
каломельный (
),
каломельный (![]() )
и некоторые другие электроды. Как
правило, электроды второго рода применяют
в качестве электродов сравнения, так
как в относительном большинстве
анализируемых систем их потенциал
постоянен.
)
и некоторые другие электроды. Как
правило, электроды второго рода применяют
в качестве электродов сравнения, так
как в относительном большинстве
анализируемых систем их потенциал
постоянен.
Современные конструкции электродов сравнения включают два раствора хлорида калия, один из которых (внешний) служит солевым мостиком и одновременно предотвращает загрязнение внутреннего, исключая его контакт с анализируемым раствором. Такие электроды называют электродами с двойным солевым мостиком.
Особое место среди индикаторных металлических электродов занимают редокс-электроды или электроды III рода, служащие для измерения окислительно-восстановительного потенциала системы. В качестве редокс-электродов применяют благородные металлы: платину, золото, иридий или графит. Металлический электрод погружен в раствор, который содержит окисленную или восстановленную форму этого же металла. Такие электроды рН-нечувствительны, а их потенциал определяется соотношением концентраций (активностей) окисленной и восстановленной форм редокс-пары и не зависит от материала электрода.
Примером рН-чувствительного редокс-электрода является хингидронный электрод, который представляет собой платиновую проволоку, погруженную в раствор HCl, насыщенный хингидроном (эквимолекулярное соединение хинона с гидрохиноном). Его электродная функция описывается уравнением:
![]()
![]() (7.8)
(7.8)
а потенциал:
![]() (7.9)
(7.9)
Такой электрод можно применять в интервале значений рН: 0 – 8,5; однако он неприменим в присутствии сильных окислителей и восстановителей.
Отрицательным свойством металлических редокс-электродов следует считать снижение скорости реакции ОВР вследствие взаимодействия компонентов с кислородом, а также возникновение смешанного потенциала в присутствии нескольких редокс-пар, находящихся в равновесии друг с другом.
