
- •Мпс россии российский государственный открытый технический университет путей сообщений
- •2. Виды работ с распределением времени
- •3. Перечень тем лекционных занятий
- •4. Перечень лабораторных занятий
- •5. Содержание дисциплины
- •5.1. Теоретические основы аналитической химии.
- •5.2. Количественный химический анализ
- •5.2.1. Основные понятия. Титриметрический анализ. Комплексы в аналитической химии
- •5.2.2. Кислотно-основное титрование. Комплексонометрия. Гравиметрический анализ
- •5.3. Физико-химические методы анализа
- •Рекомендуемая литература
- •Варианты контрольных заданий.
- •Контрольное задание
- •1. Качественный анализ
- •1.1. Методы разделения и концентрирования веществ
- •Задачи.
- •1.2. Окислительно-восстановительные реакции
- •Задачи:
- •1.3. Взаимодействие солей с избытком и недостатком щелочей
- •2. Количественный анализ
- •2.1. Весовой метод (гравиметрический)
- •2.2. Объемный (титриметрический метод)
- •2.3 Физико-химические методы анализа. Электрохимические методы анализа.
- •Расчет потенциала в точке эквивалентности
2.3 Физико-химические методы анализа. Электрохимические методы анализа.
Окислительно-восстановительное титрование.
В общем виде (в соответствии с ИЮПАК) реакция окисления восстановления записывается следующим образом:
 +
+
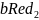 =
=
 (1)
(1)
удобно представить как сумму двух полуреакций, в которых окислитель сопряжен со своим восстановителем
a│ +
+
 =
=
 (2)
(2)
b│ +
+
 =
=
 (3)
(3)
Количественной характеристикой окислительно-восстановительной системы является окислительно-восстановительный потенциал, величина которого определяется уравнением Нернста:
E
=
 +
+
 * lg
* lg
 (4)
(4)
Здесь
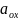 и
и
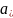 - равновесные активности окисленной и
восстановленной форм вещества,
- стандартный нулевой потенциал системы.
Формально он равен потенциалу при
условии, когда активность всех участников
реакции (
,
и т.д.) равна 1 моль-экв/л;
- равновесные активности окисленной и
восстановленной форм вещества,
- стандартный нулевой потенциал системы.
Формально он равен потенциалу при
условии, когда активность всех участников
реакции (
,
и т.д.) равна 1 моль-экв/л;
R - газовая постоянная, 8,3144 Дж/К*моль,
T - температура, К:
F
- число Фарадея, 96500 Кл/моль-экв. При

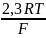 =
0,059.
=
0,059.
Пример 1.
Вычислить окислительно-восстановительный потенциал системы +e= , если [ ] = 0,005 моль/л, [ ] = 0,1 моль/л, = 0,771 В.
Решение:
По формуле (4), полагая
E
= 0,771
+
0,059*
lg
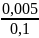 = 0,695
В
= 0,695
В
Количественно глубину протекания обратимой реакции (1) характеризует константа равновесия
Kp
=
 (5)
(5)
Величина константы может быть вычислена, если воспользоваться стандартными нулевыми потенциалами:
Kp
=
 (6)
(6)
Здесь
z - общее число электронов, участвующих
в окислительно-восстановительном
процессе, z = a =
b
=
b .
Потенциал
.
Потенциал
 относится к окислителю, а
относится к окислителю, а
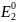 - восстановителю.
- восстановителю.
Пример 2.
Вычислить константу равновесия реакции окисления железа (II) бихроматом в стандартных условиях.
Решение:
Уравнение реакции:
1│
 + 14
+ 6e
= 2
+ 7
+ 14
+ 6e
= 2
+ 7
 = 1,36 В
= 1,36 В
6│
- e
=
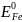 = 0,77 В z
= 6
= 0,77 В z
= 6
________________________________________________
+ 14 + 6 = 2 + 6 +7
Константа равновесия данной реакции
lgKp
= 6 *
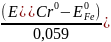 = 6 *
= 6 *
 = 60 ,
Kp =
= 60 ,
Kp =
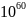
Если в полуреакции принимают участие ионы водорода, то ее можно записать в следующем виде:
Ох
+ nе
+ q
= Red +
 (7)
(7)
а формула Нернста примет вид
E
=
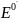 +
+
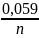 * lg
* lg
 (8)
(8)
Потенциал относится к стандартному состоянию, когда рН =0. При другой постоянной кислотности раствора уравнение (7) примет вид:
E = + * lg , где = – * pH (9)
является реальным (условным) нулевым потенциалом, характеризующим окислительные свойства вещества в конкретных.условиях, легко оценивается и используется в практических расчетах.
Пример З.
Вычислить реальные нулевые потенциалы реакции окисления железа (II) бихроматом при рН=3, используя полуреакции и стандартные потенциалы предыдущего примера.
Решение:
 =
=
 –
–
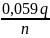 * pH
= 1,36 –
* pH
= 1,36 –
 * 3 = 0,95 В
* 3 = 0,95 В
 =
=
 = 0,77 , т.к. q
= 0
= 0,77 , т.к. q
= 0
для вычисления реальных констант равновесия в конкретных условиях используют реальные нулевые потенциалы:
Kp
=
 (10)
(10)
Пример 4.
Вычислить
скачок потенциала в пределах ± 0,1 % от
точки эквивалентности при титровании
железа (II)
перманганатом при рН = 2. При расчете
считать у
 ±=
1.
±=
1.
Решение:
Вычисляют
значение
 при степени оттитрованности 99,9 % учитывая,
что ионы водорода в полуреакции не
участвуют:
при степени оттитрованности 99,9 % учитывая,
что ионы водорода в полуреакции не
участвуют:
=
+ 0,059* lg
 = 0,77 + 0,059 * lg
= 0,77 + 0,059 * lg
 0,974 В
0,974 В
Вычисляют условный нулевой потенциал пары / при рН = 2 .
 =
=
 –
0,059 *
–
0,059 *
 pH
= 1,51 – 0,059 *
* 2
= 1,321
В
pH
= 1,51 – 0,059 *
* 2
= 1,321
В
Вычисляют потенциал системы при оттитрованности на 100,1 %
 =
+
=
+
 * lg
= 1,32 +
* lg
* lg
= 1,32 +
* lg
 = 1,286 В
= 1,286 В
Вычисляют величину скачка
∆E ± 0,01 % = - = 1,286 - 0,947 = 0,339 В.
