
- •Мпс россии российский государственный открытый технический университет путей сообщений
- •2. Виды работ с распределением времени
- •3. Перечень тем лекционных занятий
- •4. Перечень лабораторных занятий
- •5. Содержание дисциплины
- •5.1. Теоретические основы аналитической химии.
- •5.2. Количественный химический анализ
- •5.2.1. Основные понятия. Титриметрический анализ. Комплексы в аналитической химии
- •5.2.2. Кислотно-основное титрование. Комплексонометрия. Гравиметрический анализ
- •5.3. Физико-химические методы анализа
- •Рекомендуемая литература
- •Варианты контрольных заданий.
- •Контрольное задание
- •1. Качественный анализ
- •1.1. Методы разделения и концентрирования веществ
- •Задачи.
- •1.2. Окислительно-восстановительные реакции
- •Задачи:
- •1.3. Взаимодействие солей с избытком и недостатком щелочей
- •2. Количественный анализ
- •2.1. Весовой метод (гравиметрический)
- •2.2. Объемный (титриметрический метод)
- •2.3 Физико-химические методы анализа. Электрохимические методы анализа.
- •Расчет потенциала в точке эквивалентности
1.2. Окислительно-восстановительные реакции
Пример:
Допишите уравнение реакции и подсчитайте сумму коэффициентов.
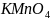 +
+
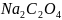 +
→
+
→
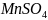 + …
+ …
Решение:

2
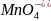 + 8
+ 8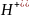 + 5ē →
+ 4
+ 5ē →
+ 4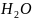
5
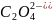 - 2ē → 2
- 2ē → 2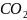
2 + 16 + 5 → 2 + 8 + 10
2
+ 5
+ 8
→ 2
+ 10
+ 8
+
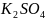 + + 5
+ + 5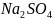
Сумма коэффициентов : 41.
Задачи:
21.
Допишите уравнение реакции и подсчитайте
сумму коэффициентов:
 +
+
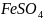 +
+
 …
…
22.
Допишите уравнение реакции и подсчитайте
сумму коэффициентов:
+
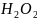 +
…
+
…
23.
Допишите уравнение реакции и подсчитайте
сумму коэффициентов:
+
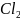 + NaOH
+ NaOH
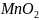 +
…
+
…
24. Допишите уравнение реакции и подсчитайте сумму коэффициентов: + KCl + → + …
25. Допишите уравнение реакции и подсчитайте сумму коэффициентов: + + …
26. Допишите уравнение реакции и подсчитайте сумму коэффициентов: + + + …
27.
Допишите уравнение реакции и подсчитайте
сумму коэффициентов:
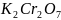 +
+
+
+
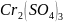 + …
+ …
28. Допишите уравнение реакции и подсчитайте сумму коэффициентов: + KJ …
29.
Допишите уравнение реакции и подсчитайте
сумму коэффициентов:
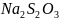 +
+
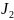 →
→
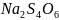 + …
+ …
30.
Допишите уравнение реакции и подсчитайте
сумму коэффициентов:
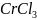 +
+ NaOH
+
+ NaOH
 + …
+ …
1.3. Взаимодействие солей с избытком и недостатком щелочей
31.
Объяснить различие во взаимодействии
соли
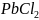 с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
32.
Объяснить различие во взаимодействии
соли
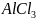 с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
33. Объяснить различие во взаимодействии соли с избытком и недостатком едкой щелочи KOH. Составить уравнения реакций.
34.
Объяснить различие во взаимодействии
соли
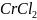 с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
35.
Объяснить различие во взаимодействии
соли
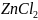 с избытком и недостатком едкой щелочи
KOH.
Составить уравнения реакций.
с избытком и недостатком едкой щелочи
KOH.
Составить уравнения реакций.
36.
Объяснить различие во взаимодействии
соли
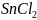 с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
с избытком и недостатком едкой щелочи
NaOH.
Составить уравнения реакций.
37.
Объяснить различие во взаимодействии
соли
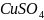 с избытком и недостатком гидроксида
аммония
с избытком и недостатком гидроксида
аммония
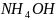 .
Составить уравнения реакций.
.
Составить уравнения реакций.
38.
Объяснить различие во взаимодействии
соли
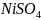 с избытком и недостатком гидроксида
аммония
.
Составить уравнения реакций.
с избытком и недостатком гидроксида
аммония
.
Составить уравнения реакций.
39.
Объяснить различие во взаимодействии
соли
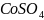 с избытком и недостатком гидроксида
аммония
.
Составить уравнения реакций.
с избытком и недостатком гидроксида
аммония
.
Составить уравнения реакций.
40.
Объяснить различие во взаимодействии
соли
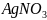 с избытком и недостатком гидроксида
аммония
.
Составить уравнения реакций.
с избытком и недостатком гидроксида
аммония
.
Составить уравнения реакций.
2. Количественный анализ
2.1. Весовой метод (гравиметрический)
Пример 1.
К
10 мл 0,03М раствора Ва прилили 5 мл 0,1М раствора
прилили 5 мл 0,1М раствора
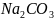 .
Сколько мг
могло остаться в растворе после
наступления равновесия?
.
Сколько мг
могло остаться в растворе после
наступления равновесия?
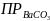 =
5.1 *
=
5.1 *
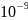
Решение:
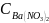 =
=
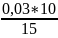 = 0,02 моль/л,
= 0,02 моль/л,
 =
=
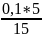 = 0,033 моль/л,
= 0,033 моль/л,
если
бы не выпадал в осадок
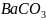 .
Однако за счет выпадения осадка
концентрация
в растворе уменьшается на 0,02 моль/л. В
растворе осталось
:
.
Однако за счет выпадения осадка
концентрация
в растворе уменьшается на 0,02 моль/л. В
растворе осталось
:
 ]
= (0,033 – 0,02) + x,
]
= (0,033 – 0,02) + x,
где
х = [
]
=
]
=
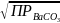 .
.
х
=
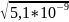 =
=
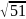 *
*
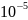 ,
этой величиной пренебрегаем, тогда в
растворе
,
этой величиной пренебрегаем, тогда в
растворе
]
= 0,033 – 0,02 = 1,3 *
 моль/л
моль/л
[
]
=
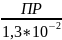 =
=
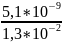 = 3,92 *
= 3,92 *
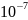 моль/л
моль/л
или
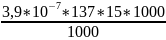 = 8,06 *
= 8,06 *
 мг.
мг.
Ответ: 8,06 * мг.
Пример 2.
В навеске 0,1341 г KCI, загрязненного хлоридом натрия, определяют содержание калия, осаждением в виде КСI04 , вес которого оказался равным 0,2206 г. Вычислить процентное содержание KCl в исследуемом образце.
Решение.
Мол. вес КСl → 74,56 KCI----- KCI04
Мол. вес KCI04 → 138,55 74,56 ---- 138,55
. Х ----- 0,2206
х = 74,56·0,2206 == 0,1187
138,55 ,
,
%
=
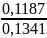 * 100 = 88,5 %
* 100 = 88,5 %
Oтвет: 88,5 %.
Пример 3.
Взвешена окись алюминия. Определить количество алюминия. Вычислить фактор пересчета.
Решение:
F
=
 =
=
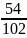 = 0,529
= 0,529
Ответ: 0,529
Пример 4.
Растворимость SrS04 при 20С равна 1,1 * r/lOO мл Н2О.
Вычислить
 ?
?
Решение:
1,1
*
г / 100мл = 1,1 *
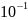 г/л,
г/л,
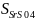 =
=
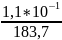 =6 · 10 моль/л,
=6 · 10 моль/л,
ПР = [ ][ ] = 6 * * 6 * = 3,6 *
Ответ: 3,6 *
Задачи:
41.
К 10 мл 0,03М раствора Ва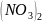 прилили 10 мл 0,2 М раствора
.
Сколько мг
могло остаться в растворе после достижения
равновесия?
= 5,1 *
прилили 10 мл 0,2 М раствора
.
Сколько мг
могло остаться в растворе после достижения
равновесия?
= 5,1 *
Ответ: 1,64 * мг.
42. К 5 мл 0,03М раствора Ва прилили 10 мл 0,1 М раствора . Сколько мг могло остаться в растворе после достижения равновесия? = 5,1 *
Ответ: 1,94 * мг.
43.
Осадили
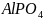 .
Взвесили
.
Взвесили
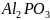 .
Определить
.
Определить
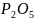 .
Вычислить фактор пересчета.
.
Вычислить фактор пересчета.
Ответ: 1,392
44.
Из навески алюминиево-калиевых квасцов
0,2690 г после соответствующей обработки
было получено 0,2584 г BaS04.Вычислить
процентное содержание КAl
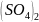 *
*
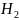 0
в исследуемой пробе квасцов.
0
в исследуемой пробе квасцов.
Ответ: 97,6 %
45.
Какой объем 4 % раствора
 *
O
израсходуется на осаждение кальция из
раствора хлористого кальция, в котором
предполагается 0,05 г
.
*
O
израсходуется на осаждение кальция из
раствора хлористого кальция, в котором
предполагается 0,05 г
.
Ответ: 4,43 мл.
46.
К 15 мл O,1M раствора Ba
прилили 15 мл 0,3 М раствора
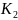 Cr
Cr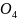 .
Сколько мг
останется
в растворе после наступления равновесия?
.
Сколько мг
останется
в растворе после наступления равновесия?
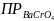 = 1,2 *
= 1,2 *
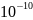
Ответ:
4,93 *
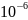 мг.
мг.
47. К 20 мл O,1M раствора Ba прилили 10 мл 0,3 М раствора Cr . Сколько мг останется в растворе после наступления равновесия? = 1,2 *
Ответ: 1,49 * мг.
48. К 10 мл O,1M раствора Ba прилили 20 мл 0,3 М раствора Cr . Сколько мг останется в растворе после наступления равновесия? = 1,2 *
Ответ: 2,95 * мг.
49.
В 1 л насыщенного раствора содержится
0,166 мг AgCNS.
Чему равно
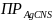 ?
?
Ответ:
10 *

50.
В 100 мл насыщенного раствора содержится
0,16 мг
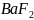 .
Чему равно
.
Чему равно
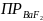 ?
?
Ответ: 3,03 *
51.
В l00
мл насыщенного раствора содержится
8,44 *
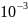 мг
мг
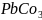 .
Вычислить
.
Вычислить
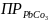 ?
?
Ответ:
1,0 *
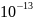
52.
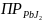 =
1,1 *
.
Вычислить растворимость
=
1,1 *
.
Вычислить растворимость
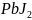 в г/l00мл
.
в г/l00мл
.
Ответ: 3,0 *
53.
Вычислить растворимость
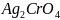 (г/100мл
),
если
(г/100мл
),
если
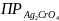 =
1,6 *
=
1,6 *
Ответ: 2,4 * г/100 мл.
