
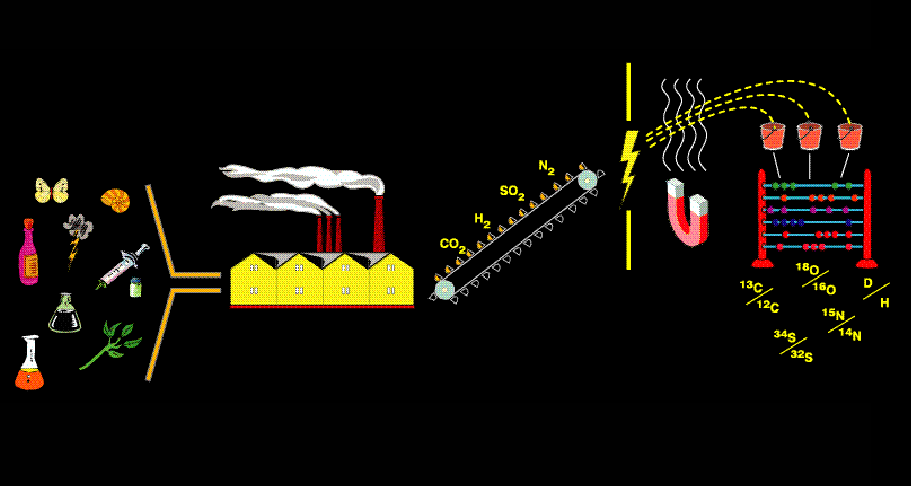
- •Определение фракционирования изотопов. Изотопы легких эл-тов. Понятие об изотопологах. Изотопная распространенность н, с, о, n
- •Представление изотопного состава легких элементов. Переход от одного изотопного стандарта к другому.
- •Vsmow-Vienna Standard Mean Ocean Water (магатэ)
- •Кинетический изотопный эффект
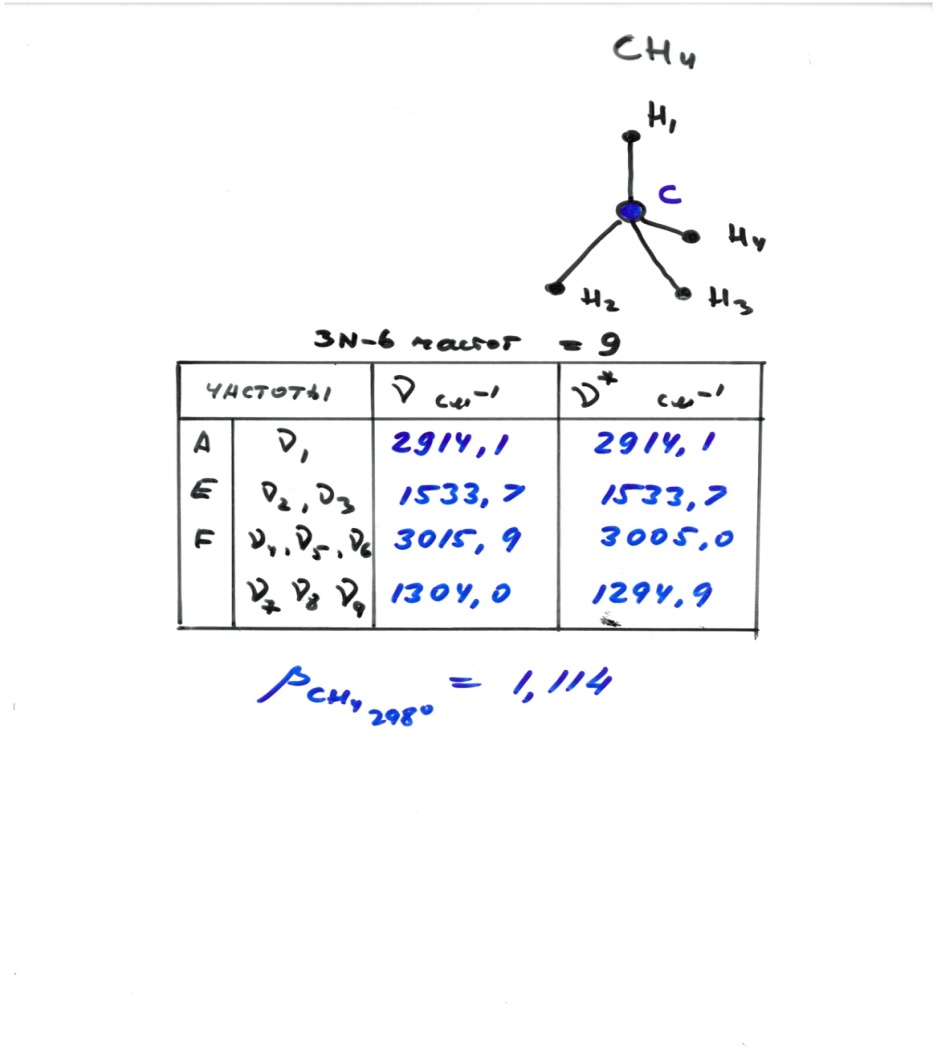
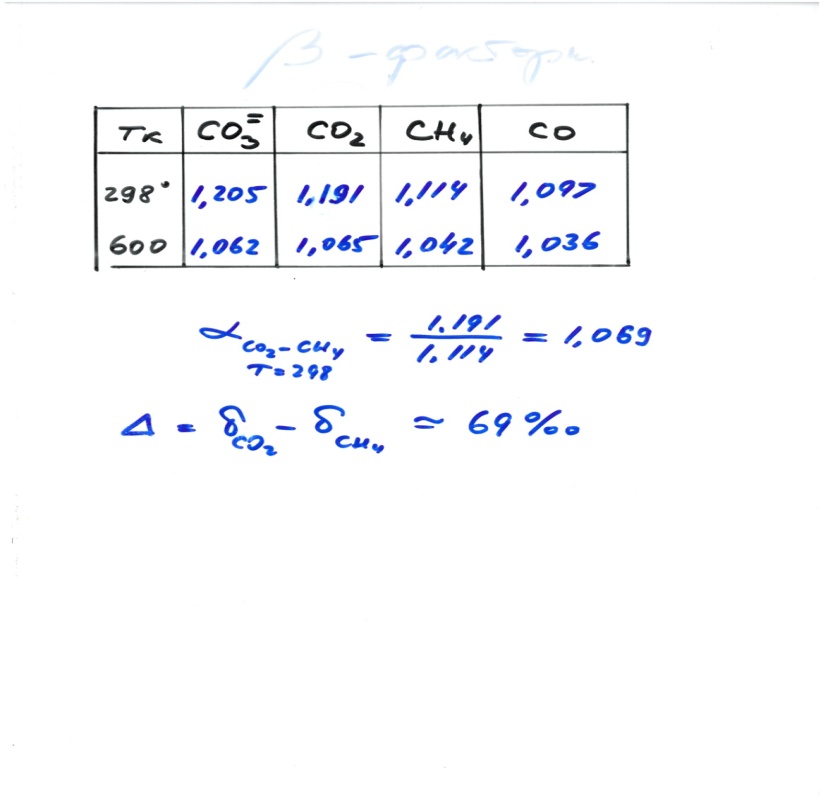
- •Термодинамический изотопный эффект. Понятие о бэта-факторе
- •Vsmow-Vienna Standard Mean Ocean Water (магатэ)
- •Изотопно-массовый баланс.
- •Статическая сумма по энергетическим состояниям. Расчет бэта-фактора
- •Термодинамическое упорядочивание изотопов. Биологический тренд. Док-во биологического происхождения нефти.
- •Масс-спектрометр изотопных отношений. Система двойного напуска газа и система с постоянным подтоком газа-носителя. Преимущества и недостатки.
- •Схемы работы установок с GasBench, tc/ea, gc/tc. Применение.
- •Методы изотопного анализа воды.
- •Р азличные виды изотопного и элементного масс-спектр анализа.
- •Оптические изотопные анализаторы
Vsmow-Vienna Standard Mean Ocean Water (магатэ)
SLAP- Standard Light Antarctic Water
GISP- Greenland Ice Standard Precipitation
Коэффициент изотопного фракционирования
αA-B=RA/RB
1. α=отношение констант скоростей необратимых (кинетических) реакций
2. α=отношение констант скоростей обратимых (термодинамических) реакций
3. α=отношение коэффициентов диффузии для идеальных газов
αA-B=(1000+δA)/(1000+δB) или
αA-B≈1+(δA- δB)/1000
Логарифмируем т.к. ln(1+x) ≈x при x<<1 получаем приближенное соотношение lnαA-B≈ln[1+(δA- δB )/1000]
1000∙lnαA-B≈(δA- δB )=ΔA-B (большая дельта)
Для идеальных газов lnαA-B~1/T2 при высоких температурах и ~1/T при низких температурах
Аналогично для пар минерал-минерал, минерал-флюид
Для sphalerite (ZnS) – galena (PbS) αA-B=1,00360 T=200°C
(сульфид цинка – сульфид свинца)
1000∙lnαA-B=3,594
ε=(αA-B-1)103
δA- δB=(βA/βB-1)1000
Изотопно-массовый баланс.
Уравнение изотопно-массового баланса
Точная формула: m0F0=m1F1+m2F2+…
Приближенная формула: m0δ0=m1δ1+m2δ2+…
δбиомасс=Xнуклδнукл+Xпротδпрот+Xсахδсах+Xлипδлип+Xлигδлиг
Статическая сумма по энергетическим состояниям. Расчет бэта-фактора
В равновесных реакциях изотопного обмена изотопы одного элемента обмениваются между двумя веществами А и В
aA1 + bB2 = aA2 + bB1 1, 2 - легкий и тяжелый изотополог
1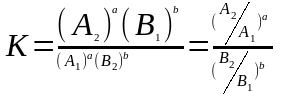 2CH4+13CO2=13CH4+12CO2
2CH4+13CO2=13CH4+12CO2
Константа равновесия
В скобках приведены концентрации исходных и конечных веществ
К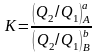 онстанту
равновесия К
можно выразить через статистическую
сумму по энергетическим состояниям
молекул Q
онстанту
равновесия К
можно выразить через статистическую
сумму по энергетическим состояниям
молекул Q
β∑A=(Q2/Q1)aA
K= β∑A/ β∑B
Изотопный обмен между SO3 и O2
1/3S16O3 + 1/218O2 = 1/3S16O3 + 1/218O2
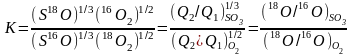
1/2O2+CO=CO2
При изотопном уравновешивании ΔGor,T=-RTln(K) - энергия Гиббса
При 300 К αСO-O=1,028 и ΔGor,T ~-69 Дж
Для химической реакции ΔGor,T =-257,200 Дж
Внутренняя энергия молекулы
Etot=Etr+Erot+Evib
ni/n0=gie(-Ei/kT) k=1,381∙1023 Дж/К
Q=∑gie(-Ei/kT) gi - статистический вес

Qtot=QvibQrotQtr
Фракционирование между фазами может быть вычислено на основании спектроскопических данных, как функция температуры.
Сумма по состояниям для поступательного движения молекул Qtr=(2πmkT)3/2/h3
Сумма по состояниям для вращательного движения молекул Qrot=(8π2IkT)/ϭh3
Ϭ- число симметрии, I – момент инерции молекулы
Сумма по состояниям для колебательного движения молекул Qvib=[1-exp(-hν/kT)]-1
ν
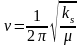 – частота
колебаний атомов в молекуле
– частота
колебаний атомов в молекуле
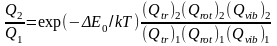
Для пары изотопологов
Δ E0 – разница нулевых энергий двух изотопологов
Расчет бэта-фактора
Lj- изотопическое число связи, j связь из числа n связей,
образуемых i атомом.
CH4: β13Cспектр.=1,1136=1+4L → LC-H=0,0284
C2H6: β13Cспектр.=1,1316 → LC-C=0,0464
Аналогично → LC-O=0,055 LC=O=0,095 LC-N
Термодинамическое упорядочивание изотопов. Биологический тренд. Док-во биологического происхождения нефти.

Масс-спектрометр изотопных отношений. Система двойного напуска газа и система с постоянным подтоком газа-носителя. Преимущества и недостатки.
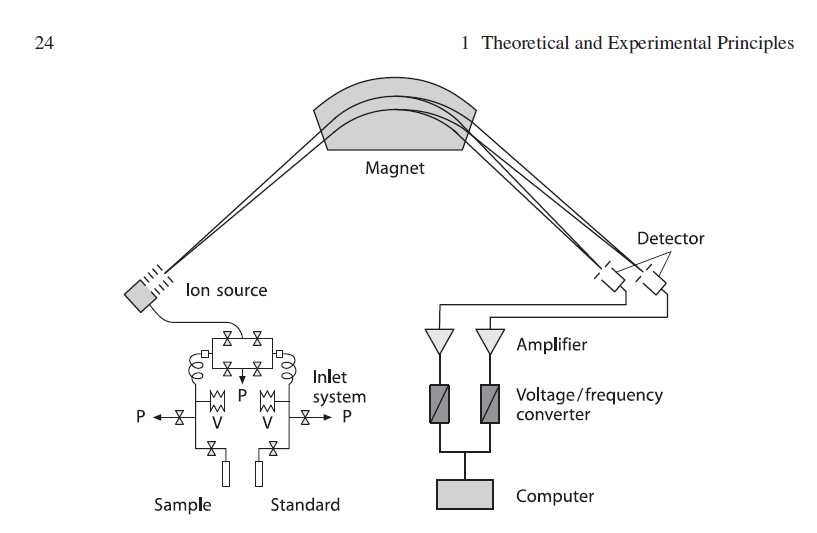
Магнитный секторный масс-спектрометр был сконструирован в 1940 г. Альфредом Ниром: ионный источник, магнитно-секторный сепаратор ионов, детектор ионов типа цилиндра Фарадея.
Давление 10-8 мбар для уменьшения числа столкновений с остаточными молекулами. Разрешение по массам R=100 (разделение изотопологов). Точность до 0,001 ‰ Ускоряющее напряжение V от 2000 до 10000 В
mv2/2=zeV Центрастремительная сила=силе Лоренца mv2/r=BzeV

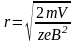
Задача ионной оптики масс-спектрометра собрать все образованные ионы и сфокусировать на коллектор.
Закон Ома: V=IR.
Изотопные ионные токи измеряются одновременно и любые изменения общего ионного тока влияют на сигнал всех детекторов.
Термическая ионизация (+,- ионы, 800-2000°С, U-Pb, Pb-Pb, Pb-Sr, Re-Os, Nd-Sm).
Уравнение Саха-Эгерта: N+/N0~exp[(W-IP)/kT]
Ионизация электронным ударом: 1 мА, 100 эВ, 1 ион на 1000-10000 молекул.
Электроны двигаются по спирали вдоль линий магнитного поля
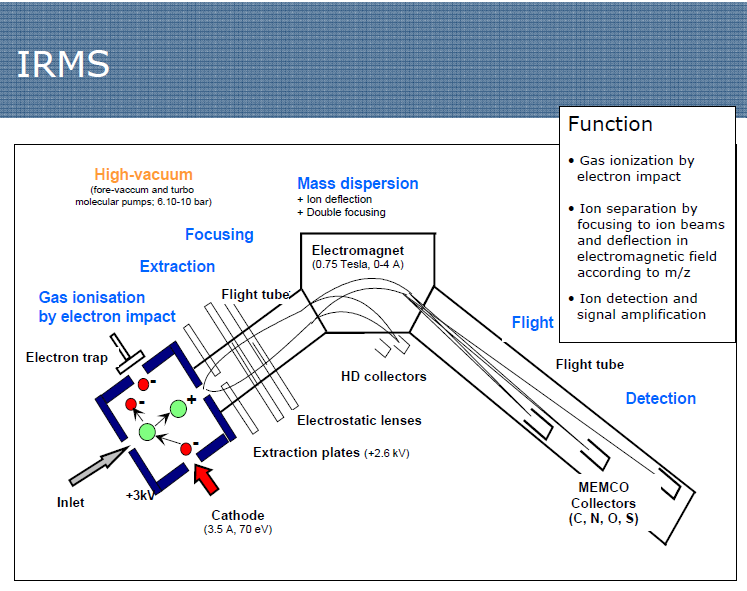
Система регистрации ионов
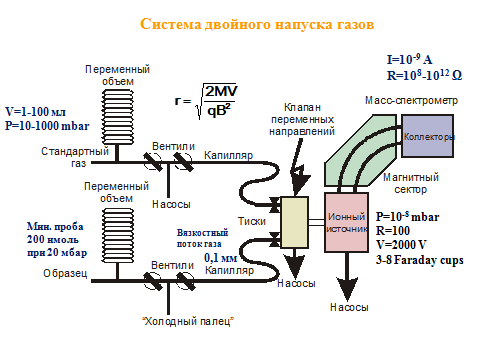
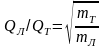
Система двойного напуска газов
Непрерывный вязкостный поток в капиллярах
Молекулярный поток: Q – поток, m – масса, Л , Т – легкий и тяжелый изотоп. Фокусировка производится с помощью магнитного поля и ускоряющего напряжения.
Dual Inlet
Измерения производятся относительно стандартного газа, попеременное измерение образца и стандарта делается много раз (10). Потоки газа из капилляров постоянные и одинаковые. Наличие «холодного пальца» для криогенного концентрирования образца (100 нмоль).
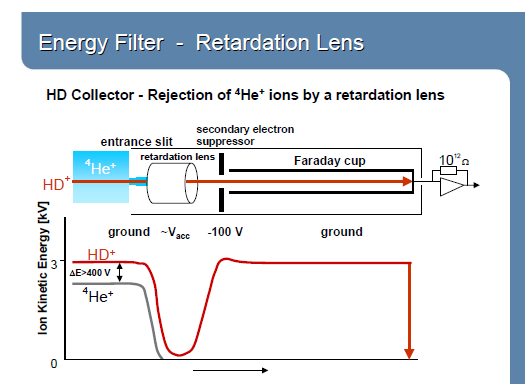
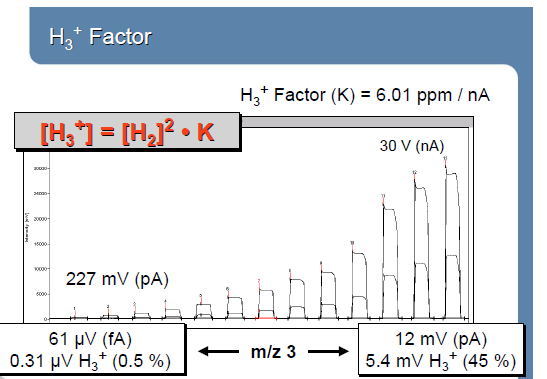
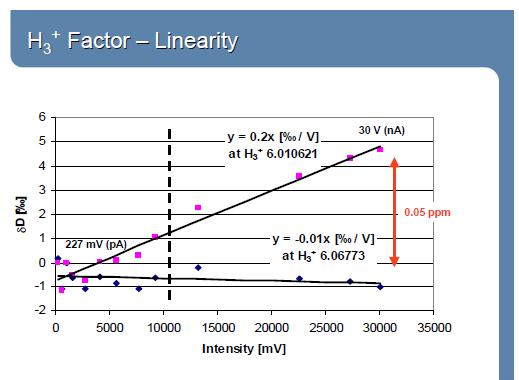
Ионно-молекулярные взаимодействия зависят от давления: Н3+ фактор.
H2+ + H2 → H3+ + H H3+~ (H2+)2
I(3)/I(2)=(HD+ + H3+)/H2+ = HD+/ H2+ + k(H2+)2/ H2+
HD+/ H2+= I(3)/I(2)-k∙I(2)

Понятие о Н3+ факторе. Минимальные анализируемые пробы и точность анализа: EA/TC-IRMS (масс-спектрометрия изотопных отношений в сочетании с пиролизатором, Continuos Flow - постоянный поток,), GC-C-IRMS (масс-спектрометрия изотопных отношений в сочетании с газовой хроматографией и реактором сожжения), LC-IsoLonk-IRMC.
Ионно-молекулярные взаимодействия зависят от давления: Н3+ фактор.
H2+ + H2 → H3+ + H H3+~ (H2+)2
I(3)/I(2)=(HD+ + H3+)/H2+ = HD+/ H2+ + k(H2+)2/ H2+
HD+/ H2+= I(3)/I(2)-k∙I(2)
Finnigan LC IsoLink - это первый доступный интерфейс, соединяющий высокоэффективный жидкостный хроматограф с масс-спектрометром для измерения стабильных изотопов для высокочувствительного, воспроизводимого и точного определения отношения 13C/12С в реальном масштабе времени. Все органические соединения, элюируемые из ВЭЖХ колонки, анализируются с сохранением хроматографического разрешения. Это открывает совершенно новый мир применений изотопной масс-спектрометрии.
Finnigan LC IsoLink ориентирован на анализ полярных и термолабильных соединений. Большинство этих соединений (таких как аминокислоты, пептиды, углнводы, нуклеотиды, спирты, oрганические кислоты) могут быть разделены хроматографически в водной фазе c использованием неорганических буфферов на ионно-обменных или обращенно-фазных ВЭЖХ колонках. Finnigan LC IsoLink позволяет проводить точное определение отношения изотопов 13C/12C в каждом индивидуальном компоненте в реальном масштабе времени.
Исследование метаболизма - Исследование аминокислот, липидов, углеводов, с использованием изотопных трейсеров - Анализ нуклеoтидов для синтеза ДНК
Пищевые продукты и их ингрeдиенты - Контроль фальсификаций меда и фруктовых соков - Определение происхождения ароматизаторов - анализ фосфолипидов, углеводов, аминокислот и витаминов
Фармацевтика - Контроль фальсификации лекарственных препаратов - Исследование субстанций и добавок
Допинговый контроль - Анализ стероидов и гормонов
Биогеохимия - История биомолекул в илах и почвах
До сих пор анализ изотопных отношений 13C/12C органических образцов был ограничен газо-хроматографическим разделением с последующим сжиганием (GC/MS, irm-GC/MS) или интегральным сжиганием образцов в элементном анализаторе. Поскольку абсолютное большинство важных для биохимии и фармацевтики соединений являются нелетучими или слишком термолабильными для использования газовой хроматографии, определение изотопных отношений 13C/12C этих компонентов в реальных аналитических применениях, обычно в сложной матрице, было невозможно или сопряжено с черейзвычайно сложной и многостадийной методикой. Finnigan LC IsoLink преодолевает барьер, который до сих пор препятствовал успешному изотопному мониторингу соединений, разделяемых высокоэффективной жидкостной хроматографией, позволяя проводить количественную, свободную от фракционирования окислительную конверсию жидкой фазы в CO2. В Finnigan LC IsoLink жидкая фаза не удаляется из образца до окисления, а образец окисляется в водном растворе и только потом CO2 извлекается из жидкой фазы для изотопного анализа. Окислительный реагент состоит из двух растворов: собственно окислительного агента и катализатора. Оба закачиваются раздельно и добавляются к мобильной фазе ВЭЖХ. Все индивидуальные органические соединения, элюируемые из ВЭЖХ колонки, количественно окисляются до CO2 в этой смеси во время прохождения через нагреваемый реактор. В модуле дегазации CO2 извлекается из жидкой фазы и переносится в поток гелия. Индивидуальные пики CO2 в He последовательно осушаются в модуле осушки (Nafion™) и затем подаются в изотопный масс-спектрометр через интерфейс с открытым сбросом. Поскольку жидкая фаза вообще не испаряется, неорганические буфферы, например фосфатные, никак не влияют на работу интерфейса и не могут аккумулироваться где-либо в системе. Это сильно отличает Finnigan LC IsoLink от любых других ВЭЖХ/МС интерфейсов и делает его абсолютно свободным от какого-либо обслуживания.
Основные характеристики Finnigan LC IsoLink |
Внешняя воспроизводимость на Finnigan LC IsoLink (n=5, 1s), d |
10 импульсов стандарта (aмплитуда 3 В), d |
Бензойная кислота (прямой петлевой ввод), 400 нг в 10 мкл воды |
|
|
Воспроизводимость (1s) |
Линейность |
Воспроизводимость (1s) |
CO2 |
CO2 |
CO2 |
13C |
0.06 ‰ |
0.02 ‰/nA |
3 нмоля бензойной кислоты = 21 нмоль (250 нг) C |
как CO2 |
< 0.3 ‰ |
|
|
|
|
Глюкоза/Фруктоза (ВЭЖХ разделение) |
600 нг каждой |
в 20 мкл воды |
|
|
|
|
3.3 нмоль глюкозы |
как CO2 |
< 0.3 ‰ |
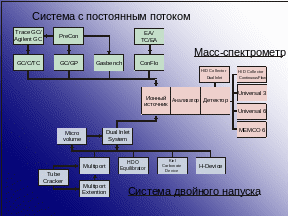
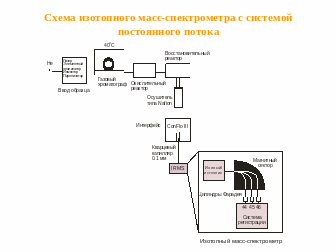
Схема работы установки EА-IRMS
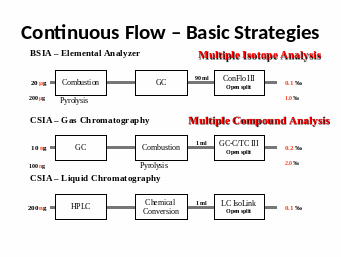
Схема работы установки GC-C-IRMS (в режиме постоянного потока газа)
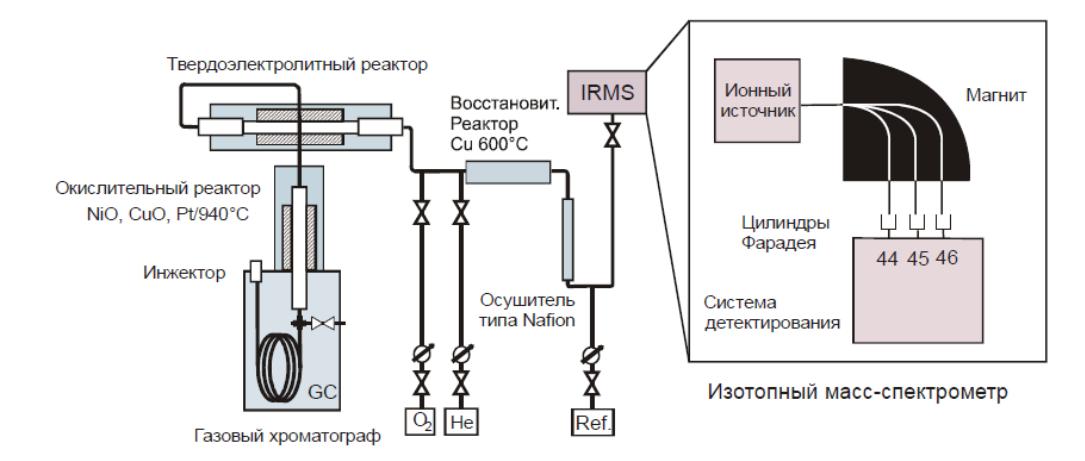
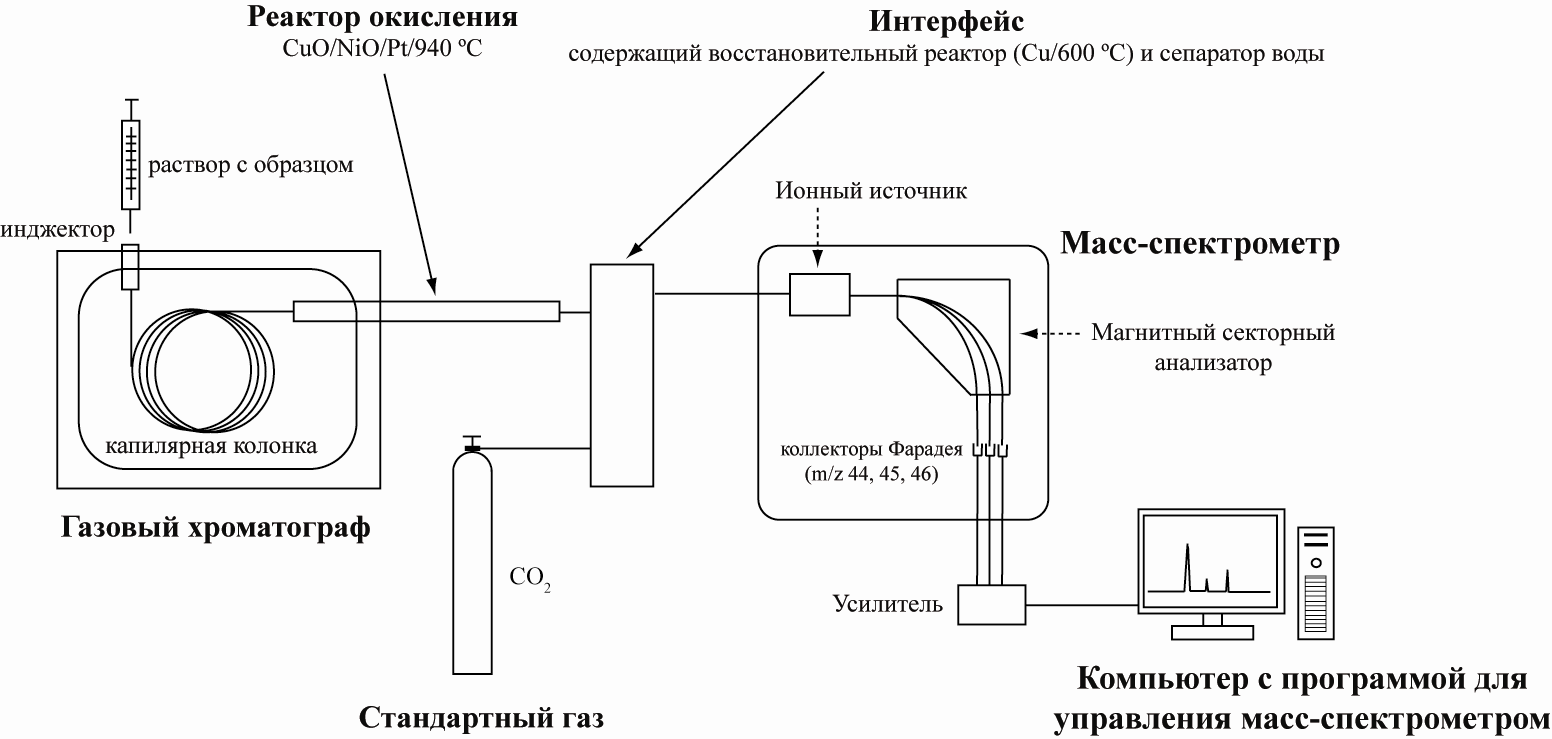
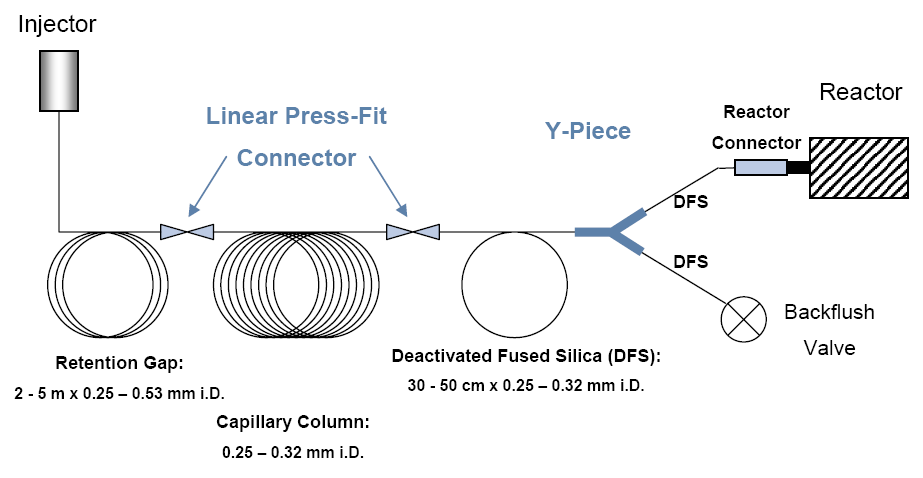
GC-C-IRMS (gas chromatography-combustion-mass spectrometry) Matthews and Hayes 1978 или CSIA (compound-specific isotope analysis) Коммерческие приборы выпускаются с 1990 г.
Образцы вводятся в поток гелия, делятся на отдельные компоненты в газовом хроматографе и попадают в ионный источник масс-спектрометра. Анализ быстрый, размер образцов небольшой, точность хуже, чем в методе DI
