
- •Факторы, влияющие на молекулярную адсорбцию
- •9 Правило Паннета-Фаянса. Изоморфизм ионов(катионы металлов 2 группы и кальций)
- •12Дисперсная фаза и дисперсионная среда. Молоко
- •14 Отличия гидрофильных коллоидов от гидрофобных. Примеры
- •15 Какими способами можно приготовить гидрофобный коллоид
- •17Как можно очистить коллоид от низкомолекулярных веществ или ионов. Гемодиализ.
- •19Электрофорез. Знак заряда гранулы по направлению.
- •20Отличие коллоида от истинного раствора по оптическим явлениям. Опалесценция. Эффект тиндаля.
- •21Что такое мицеллы пав и почему они устойчивые
- •22Влияние pH на свойства растворов белков и их устойчивость
- •23Коагуляция. Методы.
1 граница раздела фаз- переходный слой между двумя фазами Фаза- часть объема равновесной системы, однородная во всех точках по химическому составу и физическим свойствам и отделенная от других частей того же объема поверхностью раздела. Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде — между веществами, которые находятся в разных фазах (твердой и жидкой, газовой и жидкой и т. д.). Таким образом, гомогенные реакциипроисходят равномерно во всем объеме, заполненном реагентами, гетерогенные — только на некоторых пограничных поверхностях — на границе раздела фаз. Примером гетерогенной реакции может служить реакция между веществом в газовой фазе и поверхностью жидкого или твердого тела.
2
Отличие адсорбции и абсорбции. Примеры.
Единицы измерения удельной
адсорбции.
Абсорбция
- поглощение веществ из газовой смеси
жидкостями.
Адсорбция
-
поглощение вещества из газообразной
среды или раствора поверхностным слоем
жидкости или твёрдого тела.
Отличие:
адсорбция только поверхностью, а
абсорбция- всем объемом.
Пример
абсорбции: абсорбция атмосферной влаги
приводит к набуханию и последующему
расслоению деревянных изделий, химическая
абсорбция кислорода резиной - к потере
ею эластичности и растрескиванию
Примеры
адсорбции: поглощение газов и веществ
из растворов древесным углем,
глиной.
Удельная
адсорбция.
В тех случаях, когда измерить площадь
поверхности S1,2
трудно, количество i-го компонента vis
(или его массу mis)
относят к массе адсорбента m, используя
величину удельной, адсорбции ai:
![]() Если
адсорбтивом является газ, вместо его
количества (моль) или массы (кг) применяют
его объем, исходя из того, что при
нормальных условиях (0°С, 1 атм) 1 моль
любого газа занимает объем, равный 22,4
дм3.
Тогда удельная адсорбция измеряется
дм3/кг.
Если
адсорбтивом является газ, вместо его
количества (моль) или массы (кг) применяют
его объем, исходя из того, что при
нормальных условиях (0°С, 1 атм) 1 моль
любого газа занимает объем, равный 22,4
дм3.
Тогда удельная адсорбция измеряется
дм3/кг.
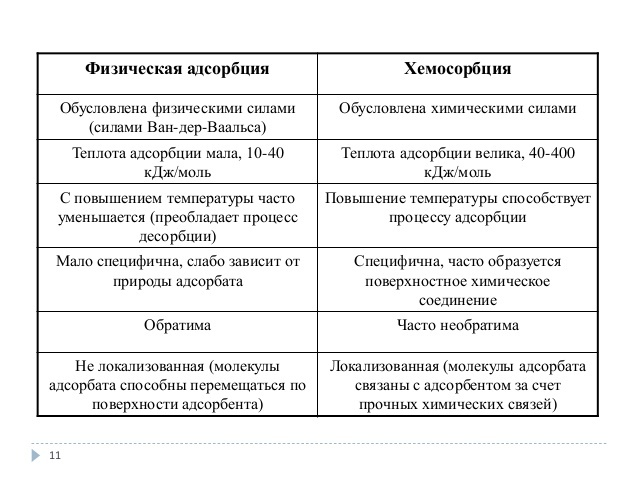
3 важнейшие отличительные характеристики химической и физической сорбции Различают два вида сорбции – физическая и химическая сорбция. Физическая сорбция вызвана Ван – дер – ваальсовыми силами взаимодействия между молекулами сорбата и сорбента. Эти силы невелики и поэтому теплота физической сорбции составляет ~ 10 – 30 кДж/моль. Химическая сорбция, или хемосорбция, обязана химической связи, возникающей между сорбатом и сорбентом. При этом образуются поверхностные соединения. Теплота хемосорбции составляет ~ 100 – 400 кДж/моль, а сам процесс хемосорбции носит активационный характер. Молекулы сорбата и сорбента должны обладать энергией, которая превышает некоторое пороговое значение (энергия активации). Энергетические характеристики этих двух видов сорбции и обуславливают их основные отличия Физическая сорбция неспецифична и ряд по сорбируемости сохраняется на любом сорбенте Химическая сорбция специфична. Данный газ может с одним сорбентом реагировать, с другим – нет
4
Изотерма адсорбции Лэнгмюра. График и
уравнение.
Основной
характеристикой адсорбции является
зависимость равновесной Гi = f(P) при
постоянной температуре. Рассмотрим
систему газ – твёрдое тело при допущениях
Лэнгмюра:
1) Адсорбент – совокупность одинаковых
адсорбционных центров, т. е. поверхность
адсорбента однородна;
2)
Межмолекулярными взаимодействиями
адсорбата на поверхности можно пренебречь;
3)
Каждый центр адсорбции взаимодействует
только с одной молекулой адсорбата,
причём молекулы адсорбата не перемещаются
по поверхности.
На поверхности может быть только один
слой адсорбата с предельным заполнением
Гм. .
Для монослойной адсорбции удобно
оперировать степенью заполнения θ, т.е.
отношением адсорбции при данном Р к
предельной адсорбции Гм:
θ = Г/Гм
Поскольку
давление Р можно измерить, а θ можно
только вычислить, последнее уравнение
разрешают относительно θ:
θ = в⋅Р − в⋅Р⋅θ,
Уравнение
носит название
уравнения Лэнгмюра

5Влияние температуры на физическую адсорбцию. Десорбция. Как её провести. Адсорбция — процесс экзотермический и, следовательно, течению его должно способствовать понижение температуры. Повышение ее способствует десорбции, вследствие чего количество адсорбированного вещества уменьшается. Для каждой температуры существует свое состояние равновесия. Чем выше концентрация адсорбата, тем больше адсорбция, а чем выше температура, тем меньше физическая адсорбция. Влияние температуры на физическую адсорбцию отвечает принципу Ле Шателье, поскольку десорбция как процесс, обратный адсорбции, сопровождается поглощением теплоты. Физическая адсорбция протекает самопроизвольно. Адсорбтив стремится занять всю поверхность адсорбента, но этому препятствует процесс, противоположный адсорбции — десорбция, вызванная, как и диффузия, стремлением к равномерному распределению вещества вследствие теплового движения. Для каждой концентрации адсорбтива в окружающей среде существует состояние адсорбционного равновесия, аналогичное равновесию между конденсацией и испарением. Понятно, что чем выше концентрация адсорбтива, тем больше адсорбция. Также ясно, что чем выше температура, тем меньше физическая адсорбция. Для каждой температуры также существует свое состояние равновесия. Влияние температуры на физическую адсорбцию вполне согласуется с принципом Ле Шателье — Брауна, поскольку десорбция как процесс, обратный адсорбции, сопровождается поглощением тепла. Десорбция- процесс обратный адсорбции Десорбция- удаление адсорбированного вещества с поверхности адсорбента. Десорбция обратна адсорбции и происходит при уменьшении концентрации адсорбируемого вещества в среде, окружающей адсорбент, а также при повышении температуры. Десорбцию применяют для извлечения из адсорбентов поглощённых ими газов, паров или растворённых веществ, а также для регенерации адсорбента. Практически при десорбции через слой адсорбента продувают горячий водяной пар, воздух или инертные газы, увлекающие ранее поглощённое вещество, или промывают слой адсорбентаразличными реагентами, которые растворяют адсорбированное вещество. Адсорбент после десорбции обычно сушат и охлаждают. Скорость десорбции зависит от температуры, природы и скорости потока десорбирующего газа или растворителя, а также от особенностей структуры адсорбента. Десорбция — один из обязательных циклов при адсорбции в аппаратах периодического действия. Десорбция в адсорберах с подвижным адсорбционным слоем протекает непрерывно.
6 что влияет на процесс адсорбции газов и паров на активированном угле? Применение активированного угля для защиты органов дыхания Независимо от природы адсорбционных сил на величину адсорбции влияют следующие факторы: 1. Природа фаз (предельная адсорбция, константа α). Кристаллические вещества адсорбируют хуже, чем аморфные. Лучше адсорбируются газы, которые легче конденсируются. Например, активированный уголь хорошо адсорбирует хлор (Ткип = 239,7 К), аммиак (Ткип = = 240 К), но не адсорбирует оксид углерода (II) (Ткип = 83 К), азот (Ткип = 77,0 К), водород (Ткип = = 20,0 К). 2. Давление (концентрация в случае адсорбции из раствора). 3. Температура. Повышение температуры способствует понижению адсорбции и усилению десорбции.
Классический пример применения активированного угля связан с использованием его в средствах индивидуальной защиты органов дыхания. Противогаз, разработанный Н. Д. Зелинским, спас множество жизней солдат в первой мировой войне после применения кайзеровской Германией боевых отравляющих веществ. Уже к 1916 году он был принят на вооружение почти во всех европейских армиях. А в 1980-е годы была разработана специальная ткань из активированного угля, которая помогла увеличить эффективность фильтров. Подобная ткань также может использоваться для улучшения экологической обстановки на планете – она очень эффективна в удалении вредных веществ из воздуха и жидкостей, мгновенно реагируя загрязнителями даже при очень низких концентрациях
7 очистка питьевой воды от загрязнений органического характера. Мед применение активированного угля. Для удаления органических веществ, находящихся в воде в виде молекулярных р-ров и придающих ей запахи и привкусы, используют аэрирование воды, окисление примесей хлором, озоном и др., адсорбцию на активированных углях-экстракцию органическими растворителями, биохимический распад. Для снижения до оптимальных или допустимых уровней минерализации, обусловливаемой ионными р-рами солей, к-т и оснований, применяют различные способы опреснения воды. При местном водоснабжении издавна применялось отстаивание, фильтрование через песок, уголь или губчатый камень, а также кипячение, которое одновременно и обеззараживает воду.
Активированный уголь, будучи физико-химическим антидотом, характеризуется высокой поверхностной активностью и отлично поглощает яды и токсины, локализирующиеся в желудочно-кишечном тракте.
Среди веществ, во избежание всасывания которых, применяется активированный уголь:
-
алкалоиды,
-
гликозиды,
-
барбитураты, глютатимид, теофиллин - в составе гемоперфузии,
-
снотворные и анестетики,
-
соли тяжелых металлов,
-
производные фенола,
-
производные синильной кислоты,
-
сульфаниламиды,
-
токсины различного происхождения - бактериального, растительного, животного,
-
газы,
-
в меньшей мере - кислоты и щелочи, соли железа, цианиды, метанол, этиленгликоль.
Чаще всего применение активированного угля происходит при отравлениях различными лекарствами, растительными ядами и прочими химическими веществами. Менее действенен уголь при отравлениях сильными кислотами, щелочами, цианидами, препаратами железа. В таких случаях активированный уголь используют для промывания желудка:
-
1 столовая ложка порошка растворяется в 1 л воды
-
по 20-30 г (иногда до 80-100 г) в виде жидкой взвеси в 100-150 мл воды.
Вводить угольный порошок (или измельчённые таблетки) в желудок необходимо до и после его промывания.
8 какие факторы влияют на адсорбцию ионов на твердых адсорбентах Избирательная адсорбция -это процесс фиксации на твердой поверхности ионов одного знака заряда при сохранении подвижности ионов противоположного знака. Процесс подчиняется правилам Панета и Фаянса
1. На поверхности кристаллов из раствора преимущественно адсорбируются ионы, имеющие сродство к поверхности. При этом адсорбцию можно рассматривать как кристаллизацию, т.е. как достройку кристаллической решетки адсорбента. Например, на поверхности кристалла AgI, внесенного в раствор AgNО3, адсорбируются ионы Аg+. Если же кристалл AgI находится в растворе КI, то избирательно адсорбируются ионы I-. Достраивать кристаллическую решетку способны не только ионы, входящие в состав решетки, но и изоморфные с ними, а также способные образовывать с ионами противоположного знака, входящими в кристаллическую решетку, труднорастворимое соединение. Так, на поверхности AgI могут адсорбироваться ионы Сl-, Вг-, СN-, SCN-.
2. На заряженной поверхности адсорбента адсорбируются те ионы, знак заряда которых противоположен знаку заряда адсорбента.
Например, известно, что поверхность каолина в воде отрицательно заряжена. Если внести каолин в раствор основного красителя - метиленового синего (ROH↔R+ + OH-), то раствор обесцветится за счет адсорбции красящего радикала R+ на отрицательной поверхности. Раствор кислого красителя - эозина ( HR ↔ H+ + R- ) в присутствии каолина цвет не меняет.
Факторы, влияющие на молекулярную адсорбцию
-
Растворитель (среда). Молекулы растворенного вещества и среды – конкуренты в борьбе за активные центры, поэтому, чем хуже адсорбируется среда на адсорбенте, тем лучше происходит адсорбция растворенного вещества. Можно считать, что чем больше поверхностное натяжение самой среды, тем меньше её молекулы склонны к адсорбции, тем полней адсорбция растворенного вещества. По этой причине адсорбция на твердом теле хорошо идет из водных растворов и хуже из растворов углеводородов, спиртов и других органических жидкостей со сравнительно малым поверхностным натяжением.
-
Природа адсорбента. Поверхности адсорбентов бывают гидрофильные (смачиваемые водой) и гидрофобные (несмачиваемые водой). Из водных растворов следует вести адсорбцию на гидрофобных адсорбентах, а из углеводородных сред - на гидрофильных. Так, в адсорбционной терапии широкое применение нашел активированный уголь, обладающий гидрофобной поверхностью. Для очистки нефтепродуктов от примесей используют различные сорта гидрофильных глин.
3. Природа адсорбата. По правилу уравнивания полярностей Ребиндера (1898-1972), вещество С может адсорбироваться на поверхности раздела фаз А и В в том случае, если его присутствие приводит к уравниванию полярностей этих фаз.
9 Правило Паннета-Фаянса. Изоморфизм ионов(катионы металлов 2 группы и кальций)
Фаянса – Панета правило, согласно которому радиоактивный изотоп, присутствующий в растворе в микроконцентрациях в форме катиона, тем сильнее сорбируется выпадающим или заранее полученным осадком, чем меньше растворимость соединения, которое образует этот катион с анионом осадка. Изоморфизм — свойство элементов замещать друг друга в структуре кристалла. Изоморфизм возможен при одинаковых координационных числах атомов, а в ковалентных соединениях при тождественной конфигурации связей.
Пример: некоторые нарушения структуры зубов являются кальций-дефицитными. Это одна из причин изоморфных замещений в структуре зубов. Замещение кальция может происходить на ионы магния, стронция, бария.
10
схема деионизации воды с последующим
применением катионита и анионита
Деионизация
воды
для полупроводниковых целей основана
на последовательном удалении из нее
катионов с помощью Н - катионита и анионов
с помощью ОН-анионита. Анионит в ОН-форме
подготавливают, промывая 2 - 5 % - ным
раствором щелочи; щелочь удаляют
деионизованной водой. Для обессоливания
воды сначала пропускают воду, содержащую
различные соли, через слой катионита в
Н - форме. При этом катионы извлекаются
из раствора, вытесняя в эквивалентных
количествах ионы Н в раствор по схемам.

11ПАВ. Примеры веществ в заряженном и нейтральном состоянии Пове́рхностно-акти́вные вещества́ (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела термодинамических фаз, вызывают снижение поверхностного натяжения.
Основной количественной характеристикой ПАВ является поверхностная активность— способность вещества снижать поверхностное натяжение на границе раздела фаз
Анионактивные ПАВ содержат в молекуле одну или неск. полярных групп и диссоциируют в водном р-ре с образованием длинноцепочечных анионов, определяющих их поверхностную активность. Пример-мыла Катионактивными наз. ПАВ, молекулы к-рых диссоциируют в водном р-ре с образованием поверхностно-активногокатиона с длинной гидрофобной цепью и аниона-обычно галогенида, иногда аниона серной или фосфорной к-ты. Пример- пиридин, хинолин, фталазин Неионогенные(нейтральные) ПАВ не диссоциируют в воде на ионы. Их р-римость обусловлена наличием в молекулах гидрофильных эфирных и гидроксильных групп, чаще всего полиэтиленгликолевой цепи. Пример-оксиэтилированные спирты.
