
- •Предмет молекулярная физика. Основные положения мкт и их анализ. Идеальный газ.
- •Статистический и термодинамический методы описания систем многих частиц. Основное уравнение молекулярно–кинетической теории идеального газа.
- •Температура. Молекулярно-кинетический смысл температуры. Основные понятия термометрии.
- •Уравнения состояние и законы идеального газа.
- •Распределение максвелла. Характерные скорости распределения максвелла и их сравнение (вывод).
- •13.Задачи термодинамики. Нулевое начало. Внутренняя энергия тел. Внутренняя энергия.
- •15. Работа в термодинамике. Вычисление работы в изопроцессах иг.
- •Теплота. Теплоёмкость. Общее выражение для теплоёмкости. Теплоёмкость иг в изопроцессах.
- •17.Первое начало термодинамики и его различные формулировки
- •19.Адиабатный процесс. Уравнение адиабаты (вывод).
- •22 Второе начало термодинамики и его различные формулировки.
- •24. Первая теорема карно. (доказательство)
- •Вторая теорема карно. Неравенство клаузиуса.
- •Энтропия как функция состояния.
- •Изменение энтропии в иг.
- •30.Метод термодинамических потенциалов. Внутренняя энергия и свободная энергия Гельмгольца.
- •31.Метод термодинамических потенциалов. Энтальпия и потенциал Гиббса.
- •32.Соотношение взаимности Максвелла и их значение.
- •33.Критерии устойчивости термодинамических систем. Принцип Ле Шателье-Брауна. Общие критерии термодинамической устойчивости
- •Принцип Ле-Шателье – Брауна
- •34.Различные формы уравнения состояния реального газа. Уравнение Ван-дер-Ваальса. Изотермы реального газа.
- •35.Изотермы газа Ван-дер-Ваальса. Метастабильные состояния.
- •36.Критические состояния. Свойства вещества в критическом состоянии.
- •37.Приведенное уравнение Ван-дер-Ваальса.
- •38.Внутренняя энергия газа Ван-дер-Ваальса.
- •41.Эффект Джоуля-Томсона. Интегральный коэффициент дросселирования (a0; b 0). Температура инверсии.
- •42.Поверхностное натяжение. Энергетический и динамический смысл коэффициента поверхностного натяжения. Методы определения.
- •43.Условия равновесия на границе двух сред (жидкость жидкость).
- •44.Условия равновесия на границе двух сред (жидкость тв. Тело). Смачивание.
- •45.Давление под искривлённой поверхностью. Капилляры и капиллярные явления. Формула Лапласа.
- •46.Фазы и фазовые превращения. Условия равновесия двух фаз химически однородного вещества.
- •47. Диаграмма состояния. Тройная точка. Равновесие трёх фаз химически однородного вещества.
- •48. Уравнение Клапейрона-Клаузиуса. Фазовые переходы.
- •49. Динамическое равновесие на границе жидкость-пар. Зависимость давления насыщенного пара от температуры.
- •53.Процессы переноса,их природа.Общее ур-е процессов переноса.
- •54.Вязкость. Закон Ньютона для вязкого трения. Коэффициент вязкости и способы его измерения.
- •55.Теплопроводность.Закон Фурье.Коэфф. Теплопроводности.
- •56.Диффузия.Закон Фика.Коэфф. Диффузии. Связь между коэфф-ми процессов переноса.
37.Приведенное уравнение Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса
-
![]()



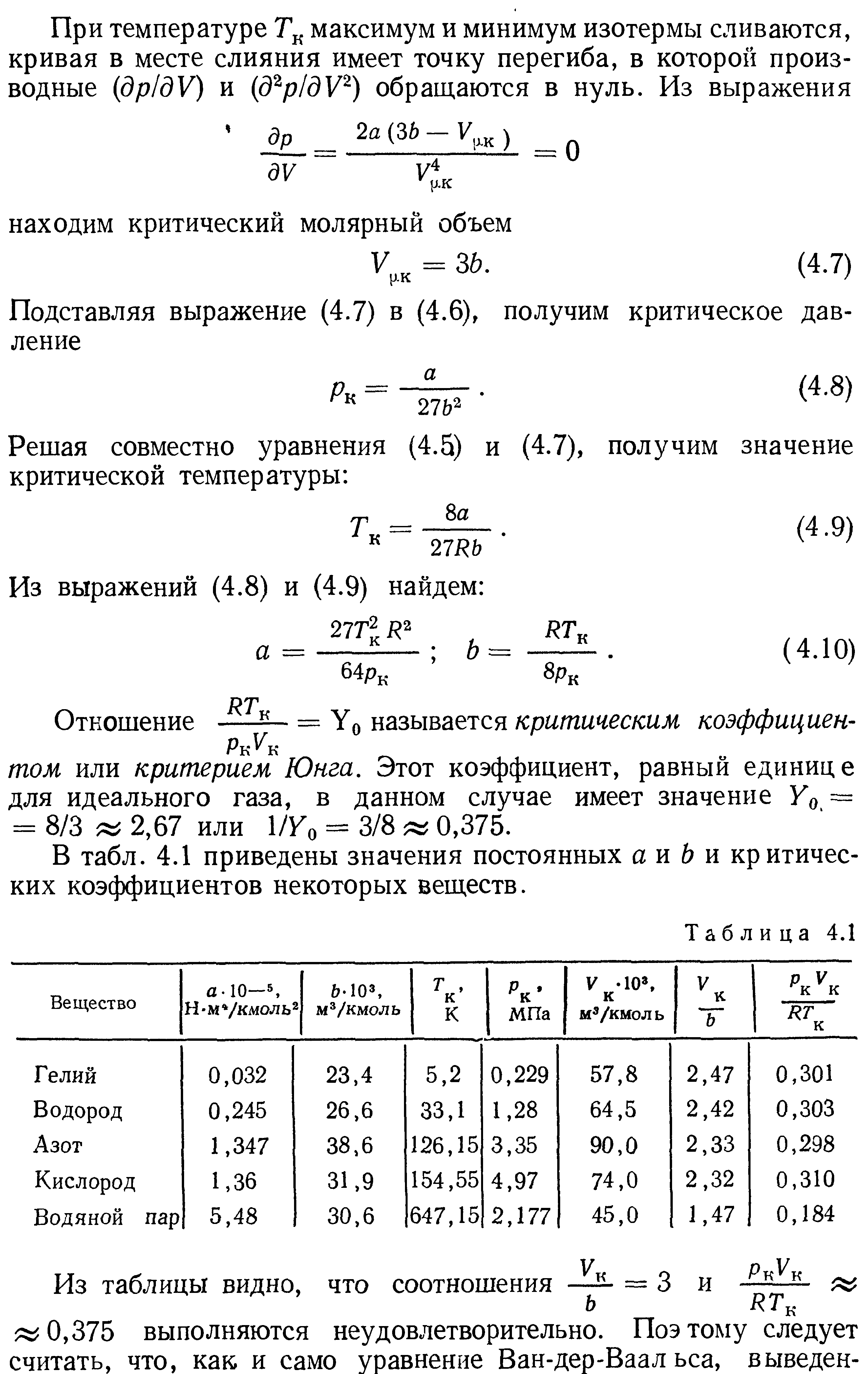

38.Внутренняя энергия газа Ван-дер-Ваальса.



39.Эффект Джоуля-Томсона. Интегральный коэффициент дросселирования (a=0; b 0).
Джоуля — Томсона эффект, изменение температуры газа в результате медленного протекания его под действием постоянного перепада давления сквозь дроссель — местное препятствие потоку газа (капилляр, вентиль или пористую перегородку, расположенную в трубе на пути потока). Течение газа сквозь дроссель (дросселирование) должно происходить без теплообмена газа с окружающей средой (адиабатически).
Д. — Т. э. был обнаружен и исследован английским учёными Дж. Джоулем и У. Томсоном в 1852—62. В опытах Джоуля и Томсона измерялась температура в двух последовательных сечениях непрерывного и стационарного потока газа (до дросселя и за ним, рис. 1). Значительное трение газа в дросселе (мелкопористой пробке из ваты) делало скорость газового потока ничтожно малой, так что при дросселировании кинетическая энергия потока была очень мала и практически не менялась. Благодаря низкой теплопроводности стенок трубы и дросселя теплообмен между газом и внешней средой отсутствовал. При перепаде давления на дросселе Dp = p1 — р2, равном 1 атмосфере (1,01×105 н/м2), измеренная разность температур DT = T2 — T1 для воздуха составила — 0,25°С (опыт проводился при комнатной температуре). Для углекислого газа и водорода в тех же условиях DТ оказалась, соответственно, равной -1,25 и +0,02°С.
Д. — Т. э. принято называть положительным, если газ в процессе дросселирования охлаждается (DТ < 0), и отрицательным, если газ нагревается (DТ > 0).
Согласно молекулярно-кинетической теории строения вещества, Д. — Т. э. свидетельствует о наличии в газе сил межмолекулярного взаимодействия (обнаружение этих сил было целью опытов Джоуля и Томсона). Действительно, при взаимном притяжении молекул внутренняя энергия (U) газа включает как кинетическую энергию молекул, так и потенциальную энергию их взаимодействия. Расширение газа в условиях энергетической изоляции не меняет его внутренней энергии, но приводит к росту потенциальной энергии взаимодействия молекул (поскольку расстояния между ними увеличиваются) за счёт кинетической. В результате тепловое движение молекул замедлится, температура расширяющегося газа будет понижаться. В действительности процессы, приводящие к Д. — Т. э., сложнее, т.к. газ не изолирован энергетически от внешней среды. Он совершает внешнюю работу (последующие порции газа, справа от дросселя, теснят предыдущие), а слева от дросселя над самим газом совершают работу силы внешнего давления (поддерживающие стационарность потока). Это учитывается при составлении энергетического баланса в опытах Джоуля — Томсона. Работа продавливания через дроссель порции газа, занимающей до дросселя объём V1, равна p1V1. Эта же порция газа, занимая за дросселем объём V2, совершает работу p2V2. Проделанная над газом результирующая внешняя работа A = p1V1 — p2V2 может быть как положительная, так и отрицательная. В адиабатических условиях она может пойти только на изменение внутренней энергии газа: A = U2 — U1. Отсюда, зная уравнение состояния газа и выражение для U, можно найти DT.
Величина и знак Д. — Т. э. определяются соотношением между работой газа и работой сил внешнего давления, а также свойствами самого газа, в частности размером его молекул.
Для идеального газа, молекулы которого рассматриваются как материальные точки, не взаимодействующие между собой, Д. — Т. э. равен нулю.
В зависимости от условий дросселирования один и тот же газ может как нагреваться, так и охлаждаться. Температура, при которой (для данного давления) разность DT, проходя через нулевое значение, меняет свой знак, называется температурой инверсии Д. — Т. э. Типичная кривая зависимости температуры инверсии от давления показана на рис. 2. Кривая инверсии отделяет совокупность состояний газа, при переходе между которыми он охлаждается, от состояний, между которыми он нагревается. Значения верхних температур инверсии (Ti, max, рис. 2) для ряда газов приведены в таблице.
Д. — Т. э., характеризуемый малыми значениями DT при малых перепадах давления Dр, называют дифференциальным. При больших перепадах давления на дросселе температура газа может изменяться значительно. Например, при дросселировании от 200 до 1 атмосферы и начальной температуре 17°С воздух охлаждается на 35°С. Этот интегральный эффект положен в основу большинства технических процессов сжижения газов.
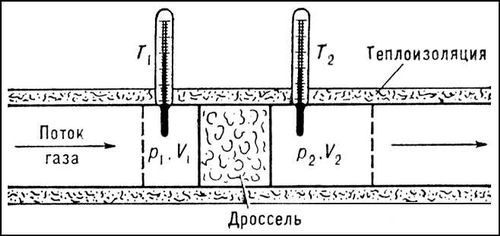 Рис.1
Рис.1
 рис.2
рис.2
