
- •Основы геологии и грунтоведения
- •Isbn 5-06-003690-1
- •Оглавление
- •Глава 1. Основные сведения о геологии 7
- •Глава 2. Земная кора и её состав 26
- •Глава 3. Грунтоведение 80
- •Глава 1. Основные сведения о геологии
- •1.1. Планета Земля
- •1.1.1. Происхождение планеты Земля
- •1.1.2. Форма Земли
- •1.1.3. Строение Земли
- •1.2. Геологическая хронология
- •1.2.1. Абсолютный возраст
- •1.2.2. Относительный возраст
- •1.2.3. Общая геохронологическая шкала
- •Глава 2. Земная кора и её состав
- •2.1. Земная кора
- •2.2. Тепловой режим земной коры
- •2.2.1. Температурные зоны
- •2.2.2. Геотермика
- •2.2.3. Многолетнемёрзлые грунты
- •2.3. Состав земной коры
- •2.3.1. Природные минералы
- •2.3.1.1. Общие сведения
- •2.3.1.2. Генезис и свойства минералов
- •2.3.1.3. Кристаллохимическая классификация минералов
- •2.3.2. Горные породы
- •2.3.2.1. Магматические породы
- •2.3.2.2. Осадочные породы
- •2.3.2.3. Метаморфические породы
- •2.3.3. Антропогенные образования
- •2.4. Расход продуктов земной коры
- •Глава 3. Грунтоведение
- •3.1. Концепция грунтоведения
- •3.2. Общие сведения о составе грунтов
- •3.3. Твёрдые компоненты грунтов
- •3.3.1. Силикаты природные (первичные)
- •3.3.2. Соли простые
- •3.3.3. Сульфиды природные
- •3.3.4. Минералы глинистые
- •3.3.4.2. Связи между минералами
- •3.3.4.3. Виды минералов
- •3.3.5 Вещества органо-минеральные
- •3.3.6. Лёд в поровом пространстве
- •3.3.6.1. Строение, виды и свойства льда
- •3.3.6.2. Мельтинг льда и режеляция воды
- •3.4. Жидкие компоненты грунтов
- •3.4.1. Вода – основная составляющая жидкого компонента
- •3.4.2. Классификация воды, пара и льда в поровом пространстве грунтов
- •3.4.2.1. Вода связанная (аномальная)
- •3.4.2.2. Вода переходного типа (от связанной к свободной)
- •3.4.2.3. Свободная вода (обычная)
- •3.4.2.4. Водяной пар (газообразная вода)
- •3.4.2.5. Лёд (твёрдая модификация воды)
- •3.5. Газообразные компоненты грунтов
- •3.5.1. Газы геологические
- •3.5.2. Газы подземные
- •3.5.3. Газы биогенные
- •3.5.4. Газы техногенные
- •3.5.5. Влияние газов на свойства грунтов
3.3. Твёрдые компоненты грунтов
Формулировка твёрдого тела. Твёрдое тело - агрегатное состояние вещества, отличающегося стабильностью формы и характером теплового движения атомов, которые совершают малые колебания около положений равновесия. Твёрдые компоненты грунтов в зависимости от вида химической и иной связи подразделяются на шесть групп, существенно различающихся по своим свойствам: 1) силикаты природные (первичные), 2) соли простые (карбонаты, сульфаты, галоиды), 3) сульфиды природные, 4) минералы глинистые, 5) вещества органо-минеральные, 6) лёд в поровом пространстве.
Твёрдые частицы, как было отмечено выше, образуют минеральный остов, определяющий основные прочностные и деформационные свойства грунтов.
3.3.1. Силикаты природные (первичные)
Природные силикаты являются наиболее распространёнными минералами земной коры. Силикаты слагают более 75 % земной коры. Различают более 500 их минеральных видов. Силикаты имеют магматическое и метаморфическое происхождение. Являются сырьём рудной промышленности, содержат особо ценные минералы (слюда, асбест), драгоценные камни (изумруд, аквамарин, топаз). Широко используются в строительной промышленности (полевые шпаты, глины).
По рассмотренной выше кристаллохимической классификации, силикаты относятся к I классу (гл. 2.3.1.3). Их высокая прочность объясняется преобладанием ковалентного (атомного) типа связи, благодаря которой образуется одна или несколько пар электронов, являющихся общими на оболочках соединяющихся атомов (рис. 3.1).
Силикаты обладают повышенной устойчивостью к воздействию внешних факторов. Не допускают эмиссию ионов в воду, т.е. не растворимы.
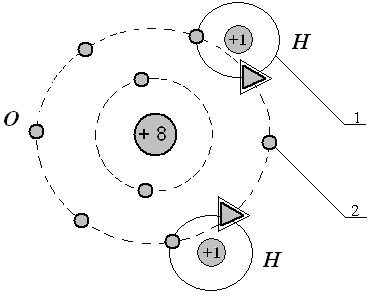
Рис.3.1 – Схема ковалентной химической (атомной) связи О—Н
на примере воды: 1 - заселённая атомная оболочка водорода
(
2 электрона:
![]() и
и
![]() ); 2 - заселённая двумя дополнительными
); 2 - заселённая двумя дополнительными
( ) электронами вторая атомная оболочка кислорода
Искусственные силикаты (вторичные) часто содержатся во многих антропогенных образованиях (гл. 2.2.3), которые создаются человеком сознательно или непреднамеренно в процессе хозяйственной деятельности. Они составляют основную долю искусственных минеральных вяжущих, а также шлаков и зол, образующихся при сжигании угля. В строительной индустрии гидравлическое вяжущее в виде искусственных минералов алита C3S и белита C2S используется для получения цементного камня, бетона при взаимодействии цемента с водой.
3.3.2. Соли простые
Группа простых солей включает минеральные вещества, имеющие ионную (электровалентную) связь между анионом и катионом (рис. 3.2), а также допускающие ковалентную связь в соответствующих радикалах. Соли простые получили широкое применение в строительстве и быту. В соответствии с классификацией грунтов по ГОСТ 25100-95, простые соли относятся к I классу, входят в группу скальных и полускальных пород осадочного типа.
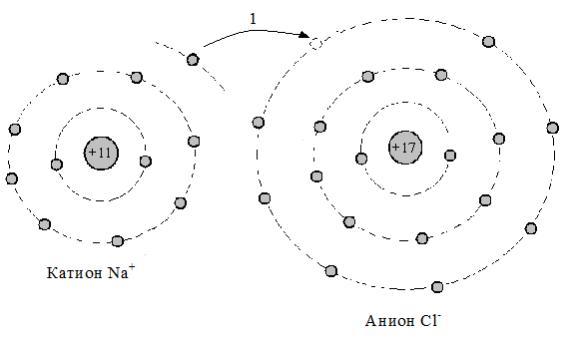
Рис.3.2 – Схема ионной химической (электровалентной) связи на примере галита: 1 – передача электрона с третьей оболочки Na на третью оболочку Cl
Таблица 4 (с. 47) представляет кристаллохимическую классификацию минералов, в т.ч. простых солей: карбонатов, сульфатов и галогенов как твёрдых компонентов грунтов. Ввиду особенностей строения и преобладающего типа связи в структуре кристаллической решётки они проявляют разную водорастворимость. Поэтому присутствие простых солей в грунтах сильно влияет на их физико-химические свойства, особенно на выщелачиваемость солей, на водопроницаемость, солевой состав порового раствора.
Карбонаты. Представляют собой соли угольной кислоты H2CO3, в которых катионами выступают ионы Са2+, Mg2+ и др. В их состав входят дополнительные ионы, чаще всего гидроксогруппы ОНˉ. Для карбонатов характерна смешанная ионно-ковалентная связь. Между катионами и анионами действует ионная связь, а в радикалах [CO3]2- – ковалентная, которая в 3…5 раз прочнее, чем ионная. Поэтому они имеют низкую растворимость (0,07 г/л).
Самый распространённый петрографический тип карбонатных грунтов – известняки. Они образуют толщи мощностью от десятков до сотен метров. Далее следуют доломиты17, мергели, глинистый известняк. В табл. 12 приведены физико-механические свойства карбонатных пород. Достаточно высокая прочность с учётом дробимости в машине Лос-Анжелеса (полочном барабане) и низкая сжимаемость позволяет использовать карбонаты в качестве щебня для приготовления асфальтобетонных смесей.
Сульфаты. Представляют собой типичные ионные минералы – соли серной кислоты H2SO4. Сульфаты щёлочных металлов (Na, K) и водные сульфаты растворимы в воде (растворимость более 2,0 г/л). Залежи сульфатов связаны с процессами осадконакопления и уплотнения в замкнутых озёрных и морских бассейнах. Наиболее
Таблица 12 – Физико-механические свойства карбонатных пород 18
Петрографические типы пород |
Структурно-генетические подтипы |
Физико-механические свойства |
|||
плотность, г/см3 |
пористость, % |
прочность, МПа |
модуль деформации, МПа |
||
1 |
2 |
3 |
4 |
5 |
6 |
Мергель |
пелитоморфные (< 0,001 мм) |
1,63 |
38,5 |
4,5 |
8,6 |
Глинистый известняк |
органогенные пелитоморфные, органогенные с пелитоморфной цементирующей массой |
1,81 |
33 |
15 |
13,0 |
Известняк |
органогенные с зернистой цементирующей массой, хемогенные пелитоморфные и тонкозернистые, хемогенные оолитовые обломочные, окремнённые тонко- и мелкозернистые, микрозернистые |
2,60
2,65
2,62 2,64 2,14
2,64 |
4
5
4 3 18,5
7 |
110
130
70 110 95
130 |
64,0
66,0
55,0 67,0 38,0
70,0 |
Доломит |
тонкозернистые мелкозернистые среднезернистые брекчиевидные |
2,64 2,76 2,64 2,46 |
7 3 6 13 |
170 260 60 60 |
70,0 81,5 50,0 - |
распространён в них гипс CaSO4·2H2O. В месторождениях руд цветных металлов (Бурибай, Сибай, Учалы и др.) в Башкирии образуются сульфаты в результате окисления природных сульфидов. Встречаются барит BaSO4 и мирабилит Na2SO4·10H2O.
Огромное количество сульфата натрия Na2SO4 находится в туркменском солёном озере бывшего залива – лагуны Кара-Богаз-Гол Каспийского моря. При низкотемпературной тепловой обработке сырья (140…190 °С) получают полуводный строительный гипс CaSO4·0,5H2O. Безводный сульфат кальция (CaSO4) являет собой ангидритовое вяжущее. Барит применяется в качестве утяжелителя глинистых тиксотропных растворов до плотности 4,05…4,25 г/см3, пригодной для использования при бурении нефтяных скважин.
Г
Рис.3.3
– Схема кубической структуры кристаллической
решётки галита
Наиболее простое строение имеет галит19 NaCl. Его структура состоит из ионов Na+ и Clˉ, попеременно располагающихся в узлах решётки и образующих плотную кубическую структуру (рис.3.3). Главная масса солей находится в растворённом виде в морях и океанах. Многие озёра содержат многолетние залежи соли NaCl. Одно из таких озёр – оз. Эльтон – расположено на юге России, в Волгоградской обл. На дне этого озера скопились залежи солей NaCl, KCl и минеральной сероводородной грязи. Аналогичным озером является Баскунчак в Астраханской обл., также имеющее на дне скопления солей. Уровень зеркала этих озёр ниже уровня мирового океана и составляет 19 м. В г. Соль-Илецк Оренбургской обл. находятся четыре минеральных насыщенных солями озера: Новое, Развал, а также грязелечебные озёра Тузлучное и Дунино.
Каменная соль NaCl встречается в недрах в твёрдом виде, образуя в земной коре мощные пласты (г. Соликамск в Пермском крае, г. Соль-Илецк), которые рассматриваются как залежи полезных ископаемых, в т.ч. поваренной соли.
Хлорид калия KCl как компонент представлен в карналлите20 KCl·MgCl2·6H2O, а в чистом виде образует сильвин21 KCl, которые встречаются в соляных месторождениях (одно из крупных – Верхнекамское в Соликамске).
Галогены – лидеры по растворимости. Галит имеет растворимость 357 г/л. В связи с этим породы отличаются интенсивным карстопроявлением (Пермский край, Оренбургская обл.). Непреднамеренное затопление соляных рудников представляет большую опасность и приносит значительный ущерб из-за неуправляемости процесса.
