
Статистическая физика
Введение: ОСНОВНЫЕ ПРИНЦИПЫ СТАТИСТИКИ
Статистика изучает закономерности, которым подчиняется поведение макроскопических тел, т.е. предметы статистики и термодинамики совпадают. Однако, в отличие от термодинамики, статистика исходит из модельных представлений о микроскопической структуре вещества. Ее задача состоит в том, чтобы устанавливать законы поведения макроскопических тел, используя законы движения частиц, из которых состоят эти тела.
Чтобы описать систему в рамках механики, нужно составить уравнения ее движения, число которых равно числу степенией свободы, и проинтегрировать их. Поскольку число степеней свободы макроскопической системы огромно, то сделать это практически невозможно.
На первый взгляд кажется, что с увеличением числа частиц свойства механической системы должны крайне усложняться и что в поведении макроскопического тела не будет даже следов закономерности. В действительности оказывается, что при большом числе частиц появляются качественно новые закономерности, не сводящиеся к механическим, которые называются статистическими. Задача статистики и состоит в установлении этих закономерностей. Поэтому статистика представляет обоснование термодинамики. Однако ее содержание не исчерпывается этим. Статистическая механика позволяет находить уравнение состояния и теплоемкость любой системы, т.е. решать задачи, которые в принципе неразрешимы в термодинамике. Наконец, статистика позволяет установить границы применимости законов термодинамики, предсказать их нарушения (флуктуации) и оценить масштаб этих нарушений. Для математической формулировки основной задачи статистической механики введем понятие фазового пространства, играющее важнейшую роль во всей статистике. Пусть имеется газ из N частиц (молекул). Между частицами происходят соударения, в результате которого устанавливается статистическое (термодинамическое) равновесие. Выделим из этой системы одну частицу и проследим как часто она будет попадать в заданный объём конфигурационного пространства V=xyz с координатами x, y, z и заданный объём импульсного пространства р=рxрyрz с координатами рx, рy, рz. Совокупность этих пространств называется фазовым пространством для одной частицы. При этом каждое состояние частицы изображается определенной точкой в фазовом пространстве. С течением времени микроскопическое состояние частицы изменяется, и фазовая точка описывает в фазовом пространстве кривую, называемую фазовой траекторией.
Основные понятия
1)
Фазовое
пространство –
для одной частицы вводится 6-мерное
пространство, его элементарный объём
![]() ,
,
dV
–
конфигурационное пространство
![]() ,
,
dp
– пространство
импульсов:
![]()
Так
что,
для одной частицы
![]() .
.
Состояние системы изображается точкой в фазовом пространстве, а изменение состояния во времени - движением точки вдоль линии, называемой фазовой траекторией.
Основной
вопрос:
нас будет интересовать вероятность
![]() ,
с которой выделенная частица попадает
в элемент фазового
пространства Г
в
процессе своего движения.
,
с которой выделенная частица попадает
в элемент фазового
пространства Г
в
процессе своего движения.
Вероятность
определяется как отношение
![]() .
.
![]() --
число частиц попавших в элемент фазового
пространства,
--
число частиц попавших в элемент фазового
пространства,
![]() общее
число частиц.
общее
число частиц.
2) Функция распределения – вероятность пропорциональна элементу ФП:
![]() ,
,
где
![]() функция распределения – плотность
распределения вероятности в ФП:
вероятность, отнесённая к единичному
элементу ФП.
функция распределения – плотность
распределения вероятности в ФП:
вероятность, отнесённая к единичному
элементу ФП.
4)
Микросостояние системы
– описание системы на микроуровне,
когда задаются координаты и скорости
всех частиц:
![]() .
Иначе: известно какие частицы
находятся в каждой фазовой ячейке.
.
Иначе: известно какие частицы
находятся в каждой фазовой ячейке.
5) Макросостояние системы – описание системы на макроуровне, когда задаются макропараметры (p, V, T, ).
Каждое макросостояние реализуется большим числом микросостояний.
Равновероятность микросостояний с энергией в интервале энергий – это утверждение относится к эргодической гипотезе.
6) Термодинамическая вероятность – число микросостояний системы, которыми реализуется одно ее макросостояние (>>1!!).
Микроканоническое распределение гиббса
Из последних положений вытекает, что все микросостояния данной системы равновероятны, вследствие чего статистический вес (число состояний, оно же и кратность вырождения!) оказывается пропорциональным вероятности макросостояния. Утверждение о равновероятности всех микросостояний лежит в основе статистической физики и носит название эргодической гипотезы.
Для замкнутой системы имеет место МИКРОКАНОНИЧЕСКОЕ РАСПРЕДЕЛЕНИЕ ГИББСА: Вероятность макросостояния пропорциональна его статистическому весу:
![]()
Фактически это следствие эргодической гипотезы: количество различных микросостояний, реализующих данное макросостояние системы, и есть статистический вес или термодинамическая вероятность макросостояния.
Замкнутая система находится с большей вероятностью в таком состоянии, которое имеет большую кратность вырождения.
Кратность вырождения – число микросостояний для заданного уровня энергии.
Доказательство того, что реальные системы являются эргодическими, - очень сложная и еще не решенная проблема.
Классические распределения
Будем рассматривать по отдельности:
1)
вероятность нахождения частицы в
элементе пространства импульсов
![]() .
Соответствующая
функция распределения называется ФР
Максвелла:
.
Соответствующая
функция распределения называется ФР
Максвелла:
![]()
2)
вероятность
нахождения частицы в элементе
конфигурационного пространства
![]() .
Соответствующая
функция распределения называется ФР
Больцмана:
.
Соответствующая
функция распределения называется ФР
Больцмана:
![]() .
.
ФР
Максвелла по проекции
импульса:

Распадается
на три функции по каждой проекции


Это
распределение есть функция от проекции
импульса
![]() и двух параметров: массаы
и температуры.
и двух параметров: массаы
и температуры.
Задание: исследовать поведение распределения от параметров: массы и температуры.
(m1=4010-27 кг; m2=3010-27 кг; Т1=300 К; Т2=600 К)
Заменой
переменной (![]() )
получим распределение
)
получим распределение
Максвелла
по проекции
скорости:

ФР
Максвелла по модулю
скорости:

v
v
v1
1ё1
v2
1ё1
vнв
1ё1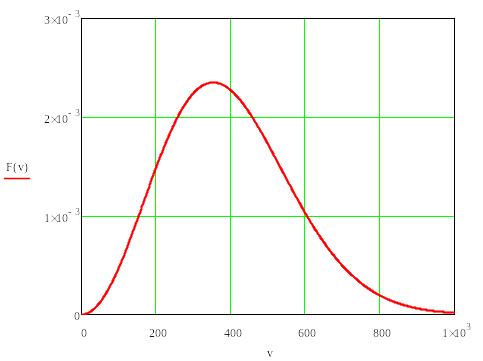
![]()
Свойства
распределения Максвелла (они следуют
из определения
![]() ):
):
Условие
нормировки
![]() -
площадь под функцией распределения
есть вероятность того, что частица имеет
скорость в интервале от 0 до
(
-
площадь под функцией распределения
есть вероятность того, что частица имеет
скорость в интервале от 0 до
(![]() );
);
Доля
частиц
![]() имеющих скорость в интервале от v1
до v2
имеющих скорость в интервале от v1
до v2
 -
площадь под функцией распределения
есть вероятность того, что частица имеет
скорость в интервале от v1
до v2;
-
площадь под функцией распределения
есть вероятность того, что частица имеет
скорость в интервале от v1
до v2;
Для
узкого интервала скоростей
v
можно
записать
![]() .
.
Зная ФР можно вычислить среднее значение любой физической величины.
Характерные скорости
Среднее
значение х-ой
компоненты
скорости:
![]()
Наиболее
вероятная скорость –
![]() –
скорость, при которой
–
скорость, при которой
![]() максимально:
максимально:
![]()
Среднее значение модуля скорости

Среднеквадратичная скорость – связана со средней энергией молекулы
![]()
Используя выражение для наиболее вероятной скорости удобно записать ФР
 ;
;
 ;
;
Распределение
по энергии (используется связь импульса
и энергии
![]() )
)
 (построить
самостоятельно)
(построить
самостоятельно)
Средняя
энергия молекул идеального газа
![]() поэтому необходимо вычислить интеграл
поэтому необходимо вычислить интеграл

Замена
переменной
![]() приводит к интегралу
приводит к интегралу
![]() .
Окончательно средняя энергия одноатомной
молекулы
.
Окончательно средняя энергия одноатомной
молекулы
![]()
Следовательно,
на одну степень свободы приходится
![]() –
из классического закона равнораспределения
энергии по степеням свободы.
–
из классического закона равнораспределения
энергии по степеням свободы.
2) вероятность нахождения частицы в элементе конфигурационного пространства .
Соответствующая функция распределения называется ФР Больцмана: .
Рассмотрим
идеальный газ в силовом поле с
потенциальной энергией, зависящей от
координат
![]()
Вероятность попадания молекулы в элемент конфигурационного пространства dV – есть распределение Больцмана
![]()
Т. е. вероятность нахождения молекулы в данном объёме зависит от её потенциальной энергии во внешнем поле сил (множитель СБ – находится из условия нормировки).
Обычно
используется не функция распределения
![]() ,
а концентрация
,
а концентрация
![]() ,
которая определяется формулой:
,
которая определяется формулой:
|
где
![]() -
полное число микрочастиц в объеме
системы.
-
полное число микрочастиц в объеме
системы.
Т.о.
концентрация частиц в силовом поле
![]()
Это распределение известно как барометрическая формула.
изобразим
бесконечно малый выделенный объем газа
![]() ,
находящийся в равновесии. Снизу на этот
выделенный объем газа воздействует
давление
,
находящийся в равновесии. Снизу на этот
выделенный объем газа воздействует
давление
![]() ,
а сверху - соответственно давление
,
а сверху - соответственно давление
![]() .
Условие механического равновесия для
объема газа
запишется
в виде:
.
Условие механического равновесия для
объема газа
запишется
в виде:
|
|
или
|
где:
![]() -
плотность газа,
-
плотность газа,
![]() -
ускорение свободного падения,
-
ускорение свободного падения,
![]() -
масса одной молекулы газа.
-
масса одной молекулы газа.
|
|||||||
|
|||||||
Из
МКТ
|
|
||||||
|
|
||||||
и
уравнение для давления газа:
|
|
||||||
Интегрирование
приводит к зависимости давления от
высоты
Или через молярную массу |
|
|
|||||
|
|
|
|||||
|
|
Эта зависимость носит название барометрической формулы. Она, в частности, позволяет рассчитывать зависимость давления атмосферы от высоты в случае, если температура атмосферы постоянна, а гравитационное поле - однородно. Для реальной атмосферы Земли на высотах примерно до 10 км её температура уменьшается в среднем на 6 К на 1 км подъема. Далее до высот порядка 20 км температура остается практически постоянной, а выше - постепенно возрастает до ~ 270 К на высоте около 55 км. На этой высоте давление атмосферы становится уже меньше 0,001 от атмосферного давления на уровне моря.
Для концентрации получим
|
|
что совпадает с более общим выражением для распределения Бльцмана.
Это распределение позволяет рассчитывать концентрацию газа, находящегося в равновесном состоянии во внешнем силовом поле. Причем это поле не должно быть обязательно гравитационным, а может иметь любое происхождение, в частности, быть электростатическим или полем сил инерции.
Пример. Ротор центрифуги вращается с угловой скоростью ω. Используя функцию распределения Больцмана, установить распределение концентрации n частиц массой m, находящихся в роторе центрифуги, как функцию расстояния r от оси вращения.
Потенциальная
энергия центробежных сил
![]()

Анализ
распределения Больцмана показывает,
что концентрация молекул газа тем выше,
чем меньше их потенциальная энергия.
Кроме этого, с понижением температуры
увеличивается отличие концентраций в
точках с различными значениями
потенциальной энергии молекул. А при
стремлении температуры к абсолютному
нулю, молекулы начинают скапливаться
в месте, где их потенциальная энергия
принимает наименьшее значение. Указанные
особенности распределения Больцмана
являются следствием теплового движения
молекул, так как кинетическая энергия
их поступательного движения в среднем
равна
![]() и
уменьшается пропорционально уменьшению
температуры. А уменьшение кинетической
энергии приводит к уменьшению количества
молекул, способных преодолеть потенциальный
порог, высота которого характеризуется
потенциальной энергией.
и
уменьшается пропорционально уменьшению
температуры. А уменьшение кинетической
энергии приводит к уменьшению количества
молекул, способных преодолеть потенциальный
порог, высота которого характеризуется
потенциальной энергией.
Пример. Среднее значение координаты молекулы в однородном гравитационном поле:
 .
.
Среднее значение потенциальной энергии молекул газа:
![]() .
.


 ,
, .
. ,
,