
- •Министерство аграрной политики украины луганский национальный аграрный университет
- •Воловик в.Н., Калайдо ю.Н.
- •Рецензенты:
- •Издание рассмотрено и рекомендовано к печати на заседании кафедры физико-математических дисциплин (протокол № от 2007г.);
- •Содержание
- •Введение
- •Математическая обработка результатов измерений физических величин.
- •1. Измерения. Виды измерений.
- •2. Системы единиц измерения.
- •3. Погрешности. Виды погрешностей.
- •4. Определение случайных погрешностей при прямых измерений.
- •Решение.
- •Техника безопасности и правила поведения в физической лаборатории.
- •Лабораторная работа № 2.1
- •Теоретическое введение.
- •Явление внутреннего трения описывается законом Ньютона:
- •Описание прибора.
- •Порядок выполнения работы.
- •Контрольные вопросы.
- •Литература.
- •Теоретическое введение.
- •Описание лабораторной установки.
- •Порядок выполнения работы.
- •Контрольные вопросы.
- •Литература.
- •Лабораторная работа № 2.3
- •Теоретическое введение.
- •Подставив в отношение выражения для Cv и Ср (7), (8) можно вывести:
- •Описание прибора и метода измерений.
- •Порядок выполнения работы.
- •Контрольные вопросы.
- •Литература.
- •Определение коэффициента поверхностного натяжения жидкости объЕмно-капельным методом.
- •Теоретическое введение.
- •Описание лабораторной установки и метода измерения.
- •Поэтому
- •Порядок выполнения работы.
- •Контрольные вопросы.
- •Литература.
- •Определение коэффициента поверхностного натяжения по высоте поднятия жидкости в капиллярной трубке.
- •Теоретическое введение.
- •Порядок выполнения работы.
- •Контрольные вопросы.
- •Литература.
- •Отчет по лабораторной работе №_____
- •Измерений рср по значению параметра t
Подставив в отношение выражения для Cv и Ср (7), (8) можно вывести:
![]() , (12)
, (12)
где і – число степеней свободы молекул газа, значение которого зависит от числа атомов в молекулах.
В данной работе необходимо определить
значение показателя адиабаты (коэффициента
Пуассона) =![]() для воздуха, используя метод адиабатного
расширения – методом Клемана и
Дезорма.
для воздуха, используя метод адиабатного
расширения – методом Клемана и
Дезорма.
Описание прибора и метода измерений.
Для определения показателя адиабаты используется установка, изображенная на рис. 1.
Большой
стеклянный сосуд соединяется трубкой
с открытым U-образным
водяным манометром. Кран служит для
соединений сосуда с атмосферой. Открыв
кран, с помощью насоса осторожно нагнетают
в сосуд некоторое количество воздуха.
Давление внутри сосуда повышается.
Уровень жидкости в правом колене
манометра при этом начинает опускаться,
а в левом – подниматься. Нагнетают
воздух до тех пор, пока разность высот
уровней жидкостей в манометре не
достигает 5–10 см. Повышение давления
воздуха в сосуде приводит к повышению
температуры. Поэтому, прежде чем записать
возникающую разность уровней жидкости
манометра h1
(рис.1,а)
в таблицу измерений, ожидают некоторое
время (1-2 мин), пока температура воздуха
в сосуде не сравняется с к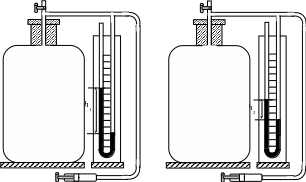 омнатной
(уровни жидкости в обоих коленах манометра
перестанут изменяться).
омнатной
(уровни жидкости в обоих коленах манометра
перестанут изменяться).
а) б)
рис. 1
З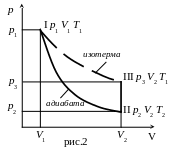 атем
необходимо вынуть из гнезда кран и, как
только правый и левый уровни манометра
сравняются (через 1-2 с), быстро вставить
кран в гнездо в закрытом положении.
Давление в сосуде сравняется с атмосферным
давлением. Процесс выпуска воздуха (его
расширение) является адиабатическим
процессом,
так как теплообмен с окружающей средой
произойти не успевает. Процесс расширения
воздуха совершается за счет его внутренней
энергии, и температура воздуха в сосуде
станет ниже комнатной. Необходимо
подождать некоторое время (2-3 мин), в
течение которого воздух будет изохорически
нагреваться до комнатной температуры.
После чего по манометру можно будет
отметить новую разность высот h2
(рис.1,б).
атем
необходимо вынуть из гнезда кран и, как
только правый и левый уровни манометра
сравняются (через 1-2 с), быстро вставить
кран в гнездо в закрытом положении.
Давление в сосуде сравняется с атмосферным
давлением. Процесс выпуска воздуха (его
расширение) является адиабатическим
процессом,
так как теплообмен с окружающей средой
произойти не успевает. Процесс расширения
воздуха совершается за счет его внутренней
энергии, и температура воздуха в сосуде
станет ниже комнатной. Необходимо
подождать некоторое время (2-3 мин), в
течение которого воздух будет изохорически
нагреваться до комнатной температуры.
После чего по манометру можно будет
отметить новую разность высот h2
(рис.1,б).
Введем обозначения для характеристики состояний воздуха в сосуде:
I состояние – p1,V1,Т1
(после накачки, до открытия крана);
II состояние – p2,V2 ,Т2 ,
(после адиабатического расширения воздуха, в момент открытия крана);
III состояние – p3,V2,Т1
(после изохорного выравнивания температур в сосуде и комнате, после закрытия крана) (рис. 2).
Причем Т1 – комнатная температура: Т1>Т2 и p2 – атмосферное давление: p2 p1.
Запишем уравнения перехода состояний.
Переход
из состояния І
в
состояние ІІ
– адиабатический
процесс
(подчиняется уравнению Пуассона):
![]() (13)
(13)
Состояния І и ІІІ имеют одинаковую (комнатную) температуру Т1 (изотермический процесс), поэтому их можно связать законом Бойля-Мариотта:
![]() (14)
(14)
Возведем уравнение (14) в степень и разделим на уравнение (13).
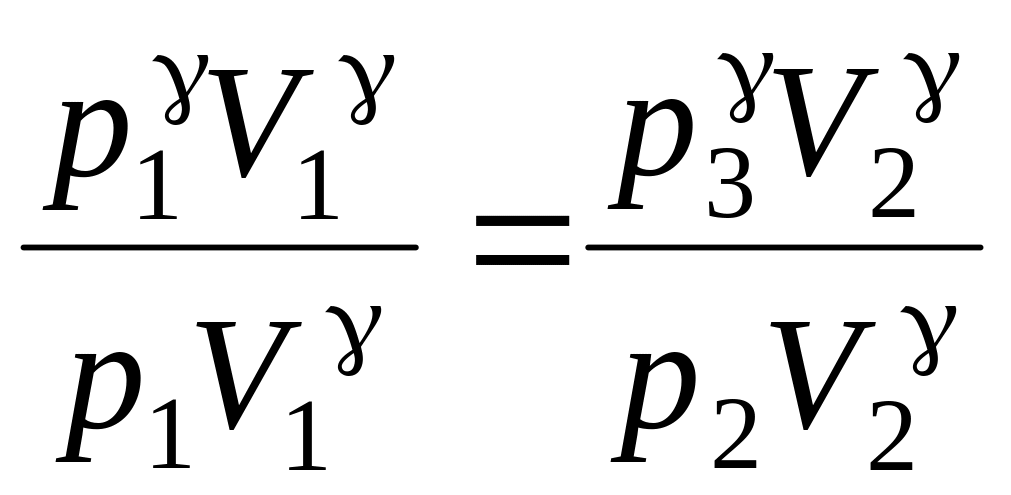 или
или
![]()
Откуда
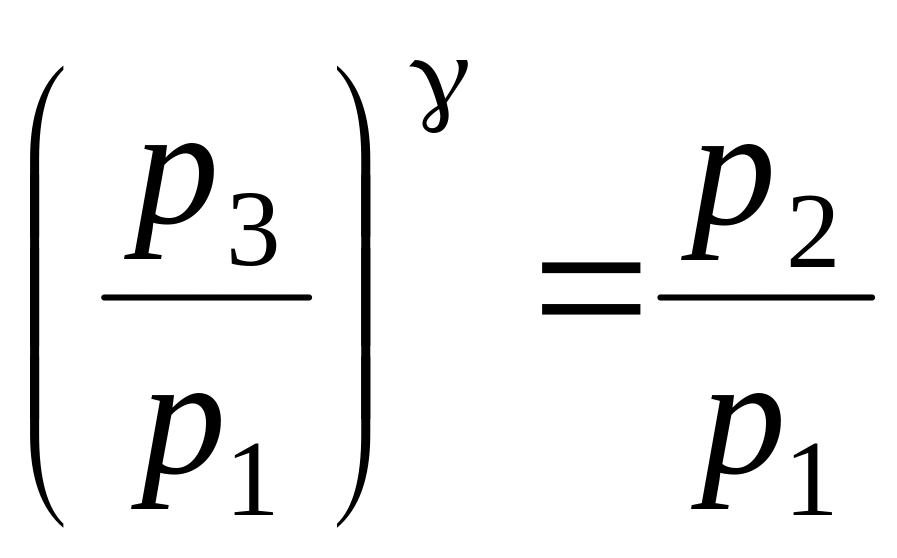
Логарифмируя последнее выражение, находим:
![]() . (15)
. (15)
Выразим давления р1 и р3 через атмосферное давление р2:
![]() и
и ![]() ,
,
где d – удельный вес жидкости в манометре.
Подставив значения р1 и р3 в уравнение (15), получим:
![]() ,
,
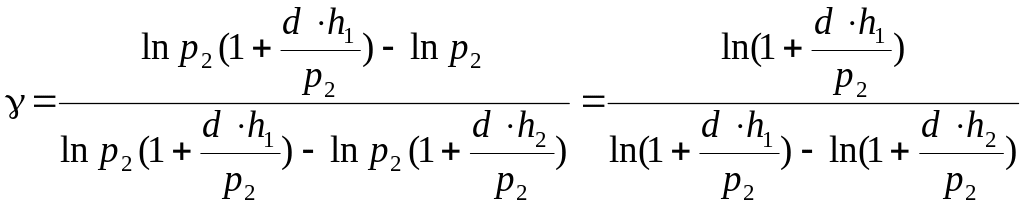 ,
,
Так
как
![]() ,
,
![]() (разлагаем логарифмы в ряд и пренебрегаем
членами второго порядка), то это дает
расчетную формулу:
(разлагаем логарифмы в ряд и пренебрегаем
членами второго порядка), то это дает
расчетную формулу:
![]() . (16)
. (16)
Формула (16) является расчетной при определении значения показателя адиабаты (коэффициента Пуассона) = . Необходимо знать избыточное (над атмосферным) давление в баллоне до адиабатического расширения газа и его избыточное давление после изохорного нагревания.
Следует подчеркнуть, что обе величины должны измеряться в состоянии термодинамического равновесия, то есть после прекращения теплообмена.
